题目内容
8.A、B、C、D、E、F是原子序数依次增大的六种常见元素.E的单质在C2中燃烧的产物可使品红溶液褪色.F和C元素形成的化合物F3C4具有磁性.A的单质在C2中燃烧可生成AC和AC2两种气体.D的单质是一种金属,该金属在AC2中剧烈燃烧生成黑、白两种固体.请回答下列问题:(1)B的单质分子的电子式为
 ;F3C4的化学式为Fe3O4;F元素在周期表中的位置是第4周期第Ⅷ族.
;F3C4的化学式为Fe3O4;F元素在周期表中的位置是第4周期第Ⅷ族.(2)写出D在AC2剧烈燃烧生成黑白两种固体的化学反应方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
(3)A、B、C形成的10电子氢化物中,A、B的氢化物沸点较低的是(写化学式)CH4;B、C的氢化物分子结合H+能力较强的是(写化学式)NH3,用一个离子方程式加以证明NH3+H3O+=NH4++H2O.
(4)EC2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体BC,有关反应的离子方程式为3SO2+2NO3-+3Ba2++2H2O═3BaSO4↓+2NO↑+4H+,由此可知BC2和EC2还原性较强的是(写化学式)SO2.
分析 E的单质在C2中燃烧的产物可使品红溶液褪色,该气体为SO2,则E为S元素,C为O元素,F和C元素形成的化合物F3C4具有磁性,则F3C4为Fe3O4,F为Fe元素,A的单质在C2中燃烧可生成AC和AC2两种气体,A原子序数小于O元素,应为CO和CO2气体,A为碳元素,D的单质是一种金属,该金属在AC2中剧烈燃烧生成黑、白两种固体,应为Mg和CO2的反应,则A为Mg元素,B的原子序数介于碳、氧之间,则B为N元素,据此解答.
解答 解:E的单质在C2中燃烧的产物可使品红溶液褪色,该气体为SO2,则E为S元素,C为O元素,F和C元素形成的化合物F3C4具有磁性,则F3C4为Fe3O4,F为Fe元素,A的单质在C2中燃烧可生成AC和AC2两种气体,A原子序数小于O元素,应为CO和CO2气体,A为碳元素,D的单质是一种金属,该金属在AC2中剧烈燃烧生成黑、白两种固体,应为Mg和CO2的反应,则A为Mg元素,B的原子序数介于碳、氧之间,则B为N元素.
(1)B的单质是氮气,其电子式为: ,F3C4的化学式为Fe3O4,F是Fe元素,位于第四周期第VIII族,故答案为:
,F3C4的化学式为Fe3O4,F是Fe元素,位于第四周期第VIII族,故答案为: ;Fe3O4;第4周期第Ⅷ族;
;Fe3O4;第4周期第Ⅷ族;
(2)镁在二氧化碳中燃烧生成氧化镁和碳,反应方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(3)A、B、C形成的10电子氢化物分别是CH4、NH3、H2O,氨气和水中都存在氢键,导致氨气和水的沸点升高,甲烷中不含氢键,所以沸点最低的是CH4,氨气为碱性气体,NH3结合H+能力较强,用一个离子方程式加以证明:NH3+H3O+=NH4++H2O,
故答案为:CH4;NH3;NH3+H3O+=NH4++H2O;
(4)二氧化硫和氯化钡、硝酸溶液反应生成硫酸钡沉淀、无色气体NO,其离子反应方程式为:3SO2+2NO3-+3Ba2++2H2O═3BaSO4↓+2NO↑+4H+,该反应中二氧化硫失电子作还原剂,一氧化氮是还原产物,所以二氧化硫的还原性较强,
故答案为:3SO2+2NO3-+3Ba2++2H2O═3BaSO4↓+2NO↑+4H+;SO2.
点评 本题考查元素化合物推断,需要学生熟练知识元素化合物知识,是对学生综合能力的考查,注意镁能在二氧化碳中燃烧,酸性条件下二氧化硫能被硝酸根离子氧化.

| A. | 气态氢化物的稳定性:HX>H2Y>ZH3 | B. | 非金属活泼性:Y<X<Z | ||
| C. | 单质的氧化性:X>Y>Z | D. | 原子最外电子层上电子数不等 |
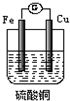
| A. | 装置中铜是负极 | |
| B. | 铜表面的反应为:2H++2e-=H2↑ | |
| C. | 电流的方向是从铁经导线流向铜 | |
| D. | 构成原电池后,铁与硫酸铜的反应速率加快 |
| A. | 反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(NH3):n (O2)=4:5 | |
| B. | 反应达到平衡后,对体系一直进行加压,平衡总是向逆向移动 | |
| C. | 反应达到平衡时,若向压强固定的密闭容器中充入稀有气体,平衡不移动 | |
| D. | 当v正(NH3):v正(NO)=1:1 时,说明该化学反应已经达到平衡 |
 .下列有关双酚A的叙述不正确的是( )
.下列有关双酚A的叙述不正确的是( )| A. | 能和NaOH溶液反应 | B. | 能和FeCl3溶液发生显色反应 | ||
| C. | 能和浓溴水反应 | D. | 苯环上一溴代物有四种 |
| A. | 1.8g | B. | 2.7g | C. | 3.6g | D. | 5.4g |



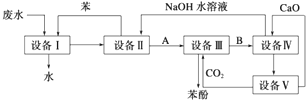 含苯酚的工业废水的处理流程如图所示.
含苯酚的工业废水的处理流程如图所示. ;
;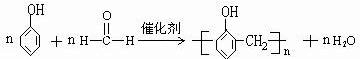 .
.