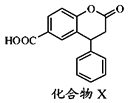
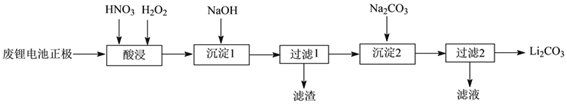
题目内容
【题目】若用AG表示溶液的酸度,其表达式为AG= 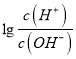 室温下,实验室里用0.1mol/L的盐酸滴定10mL0.1mol/LMOH溶液,滴定曲线如图所示。下列说法正确的是
室温下,实验室里用0.1mol/L的盐酸滴定10mL0.1mol/LMOH溶液,滴定曲线如图所示。下列说法正确的是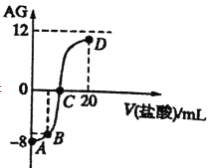
A. 该滴定过程可选择酚酞作为指示剂
B. 若B点加入的盐酸体积为5mL,所得溶液中:c(M+)+2c(H+)=c(MOH)+2c(OH-)
C. 水的电离程度:A
D. MOH的电离平衡常数为1×10-17
【答案】B
【解析】A.用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L MOH溶液,AG=-8,AG=lg[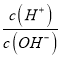 ],
], 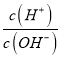 =10-8,c(H+)c(OH-)=10-14,c(OH-)=10-3mol/L,说明MOH为弱碱,恰好反应溶液显酸性,选择甲基橙判断反应终点,故A错误;B.若B点加入的盐酸溶液体积为5 mL,得到等浓度的MCl和MOH混合溶液,溶液中存在电荷守恒c(M+)+c(H+)=c(OH-)+c(Cl-),物料守恒为:c(M+)+c(MOH)=c(Cl-),消去氯离子得到:c(M+)+2c(H+)=c(MOH)+2c(OH-),故B正确;C.滴定过程中从A点到D点溶液中水的电离程度,A-B滴入盐酸溶液中氢氧根离子浓度减小,对水抑制程度减小,到恰好反应MCl,M+离子水解促进水电离,电离程度最大,继续加入盐酸抑制水电离,滴定过程中从A点到D点溶液中水的电离程度,D<A<B<C,故C错误;D.室温下,0.1mol/L MOH溶液,AG=-8,即AG=lg[
=10-8,c(H+)c(OH-)=10-14,c(OH-)=10-3mol/L,说明MOH为弱碱,恰好反应溶液显酸性,选择甲基橙判断反应终点,故A错误;B.若B点加入的盐酸溶液体积为5 mL,得到等浓度的MCl和MOH混合溶液,溶液中存在电荷守恒c(M+)+c(H+)=c(OH-)+c(Cl-),物料守恒为:c(M+)+c(MOH)=c(Cl-),消去氯离子得到:c(M+)+2c(H+)=c(MOH)+2c(OH-),故B正确;C.滴定过程中从A点到D点溶液中水的电离程度,A-B滴入盐酸溶液中氢氧根离子浓度减小,对水抑制程度减小,到恰好反应MCl,M+离子水解促进水电离,电离程度最大,继续加入盐酸抑制水电离,滴定过程中从A点到D点溶液中水的电离程度,D<A<B<C,故C错误;D.室温下,0.1mol/L MOH溶液,AG=-8,即AG=lg[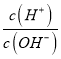 ]=-8,即
]=-8,即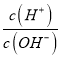 =10-8,而水的离子积K=c(H+)c(OH-)=10-14,两式联立可知:c(H+)=10-11,c(OH-)=10-3,在MOH溶液中,c(M+)≈c(OH-)=10-3,故电离平衡常数K=
=10-8,而水的离子积K=c(H+)c(OH-)=10-14,两式联立可知:c(H+)=10-11,c(OH-)=10-3,在MOH溶液中,c(M+)≈c(OH-)=10-3,故电离平衡常数K=![]() =10-5,故D错误;故选B。
=10-5,故D错误;故选B。

 阅读快车系列答案
阅读快车系列答案