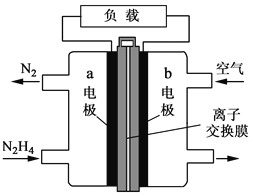
题目内容
【题目】下表为周期表的一部分,其中的编号代表对应的元素。
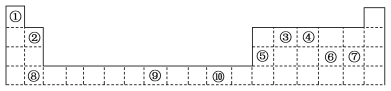
请回答下列问题:
(1)表中属于d区的元素是________(元素符号)。
(2)写出元素溴的基态原子的简化电子排布式_____________________,写出⑩的价电子排布图_____________________________________。
(3)某元素⑦的原子核外最外层电子的成对电子为________对。
(4)元素④的氢化物的分子构型为________,中心原子的杂化形式为________。
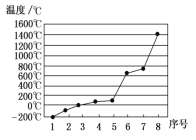
(5)第三周期8种元素按单质熔点高低的顺序如下图,其中序号“⑧”为________(填元素符号);其中电负性最大的是________(填元素符号)。
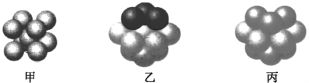
(6)⑩的基态原子有____种能量不同的电子;如图___(填“甲”、“乙”或“丙”)表示的是⑩晶体中微粒的堆积方式。晶体中距离一个⑩原子最近的⑩原子有____个。若该晶体中一个晶胞的边长为a pm,则⑩晶体的密度为__________g.cm-3(写出含a的表达式,用NA表示阿伏加德罗常数的值,不需化简)。若⑩的原子半径为r,则⑩晶胞这种堆积模型的空间利用率为__________。
【答案】Fe[Ar]3d104s24p5![]() 3三角锥形sp3SiCl7乙12
3三角锥形sp3SiCl7乙12![]()
![]()
【解析】
根据周期表的结构可知各元素分别为:①H ②Be ③C ④N ⑤Al ⑥S ⑦Cl ⑧Ca ⑨Fe ⑩Cu;
(1)d区元素包括ⅢB-ⅦB元素,Ⅷ族元素,为第3列到10列元素(镧系元素、锕系元素除外),由元素在周期表中位置可以知道,⑨元素Fe处于第8列,为第Ⅷ族元素,属于d区的元素;因此,本题正确答案是:Fe。
(2) 溴原子的核电荷数为35,其基态原子的简化电子排布式:[Ar]3d104s24p5 ;⑩元素为Cu,核电荷数为29,原子基态电子排布式:[Ar]3d104s1, 其价电子为排布图:![]() ;综上所述,本题答案是:[Ar]3d104s24p5 ,
;综上所述,本题答案是:[Ar]3d104s24p5 , ![]() 。
。
(3)⑦元素为Cl,核电荷数为17,原子核外最外层电子为7,特征电子排布式为3s23p5, s能级为成对电子,p能级5个电子各占据3个轨道,其中一个轨道只有1个电子,所以成对电子为3对;综上所述,本题答案是:3。
(4)④元素为N,氢化物为NH3,N原子价层电子对数=3+(5-1×3)/2=4,含有1对孤对电子,故NH3为三角锥型,N原子产生sp3杂化;综上所述,本题答案是:三角锥形,sp3。
(5)第3周期8种元素中Si是原子晶体,单质的熔点最高;同周期自左而右电负性增强(稀有气体除外),故Cl元素的电负性最强;因此,本题正确答案是:Si 、Cl。
(6)⑩元素为Cu,核电荷数为29,基态核外电子排布为:1s22s22p63s23p63d104s1,因为1s、2s、2p、3s、3p、3d、4s能级能量不同,所以有7种能量不同的电子;Cu为面心立方最密堆积,是面心立方最密堆积型,故为图乙结构;根据铜晶胞可知,铜晶体为面心立方结构,顶点离面心的铜原子距离最近,一个晶胞中,一个顶点的晶胞有8个,共24个面心铜原子,1个面心铜原子由2个晶胞共有,因此晶体中距离一个铜原子最近的铜原子有12个;晶胞中Cu原子数目=8×1/8+6×1/2=4,晶胞质量=4×64/NAg,该晶体中一个晶胞的边长为a pm,则晶胞体积=(a×10-10)3cm3,晶体的密度=(4×64/NA)÷(a×10-10)3=![]() g/cm3;若Cu的原子半径为r,设晶胞边长为a,由图可知,(4r)2=a2+a2,则晶胞棱长a=4r×
g/cm3;若Cu的原子半径为r,设晶胞边长为a,由图可知,(4r)2=a2+a2,则晶胞棱长a=4r×![]() =2
=2![]() r,则晶胞体积=(2
r,则晶胞体积=(2![]() r )3,晶胞中Cu原子总体积=4×4/3πr3,则Cu晶胞这种堆积模型的空间利用率为(4×4/3πr3)/(2
r )3,晶胞中Cu原子总体积=4×4/3πr3,则Cu晶胞这种堆积模型的空间利用率为(4×4/3πr3)/(2![]() r )3=
r )3=![]() ;综上所述,本题答案是:7 ,乙 ,12,
;综上所述,本题答案是:7 ,乙 ,12, ![]() ,
,![]() 。
。