题目内容
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,下列推断正确的是
| | Q | R | |
| T | | | W |
A.T的氧化物是光导纤维的主要成分
B.W的氢化物的化学式为HCl
C.R的最高正价氧化物的水化物是弱电解质
D.Q与氢形成的化合物均含极性共价键
D
解析试题分析:根据四种短周期元素在表中的位置推断,前两种元素位于第二周期,后两种元素位于第三周期,则T为第三周期第IIIA族的铝元素,由此可知Q、R、T、W分别是碳、氮、铝、硫。光导纤维的主要成分是二氧化硅,是硅的氧化物,而不是铝的氧化物,故A错误;硫的氢化物是H2S,而不是HCl,故B错误;氮的最高正价氧化物的水化物是HNO3,硝酸是强酸,而不是弱酸,故C错误;碳与氢形成的化合物是碳氢化合物或烃,它们一定含有C—H键,碳氢键是极性共价键,故D正确。
考点:考查元素周期表、元素周期律和物质结构,主要涉及短周期元素在元素周期表中的位置、原子结构和分子结构、元素及其化合物的主要性质和重要应用的综合推断。

练习册系列答案
相关题目
依据元素周期表及元素周期律,下列推断正确的是
| A.同一周期元素的原子,半径越小越容易失去电子 |
| B.ⅠA族元素的金属性比ⅡA族元素的金属性强 |
| C.若M+和R2-的核外电子层结构相同,则原子序数:R>M |
| D.主族元素的最高正化合价等于该元素原子的最外层电子数 |
X、Y、Z、R、W是原子序数依次增大的五种短周期元素。Y和R同主族,可组成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同,25℃时,0.1mol/L X和W形成化合物的水溶液pH为1。下列说法正确的是
| A.由于非金属性Y>R,所以X、Y组成化合物的沸点高于X、R组成的化合物 |
| B.Y和其他四种元素均可形成至少两种的二元化合物 |
| C.RY2能与Y、Z形成的一种化合物反应生成Y2 |
| D.Y、Z、W三种元素组成化合物的水溶液一定显碱性 |
短周期金属元素甲-戊在元素周期表中的相对位置如表所示,下面判断正确的是( )
| 甲 | 丙 | |
| 乙 | 丁 | 戊 |
A.原子半径: 丙<丁<戊
B.金属性:丙>甲
C.最高价氧化物对应的水化物碱性:乙>丁>戊
D.戊只与强酸反应
如图所示是五种短周期元素化合价与原子序数的关系,下列说法不正确的是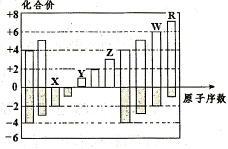
| A.原子半径:R>W>Z>Y>X |
| B.R的气态氢化物比W的气态氢化物稳定 |
| C.X与Y可形成既含离子键又含共价键的化合物 |
| D.Y的最高价氧化物对应水化物与Z的最高价氧化物 |
同一短周期内主族元素最高价氧化物对应水化物相同浓度稀溶液的pH与原子半径的关系如图,下列说法正确的是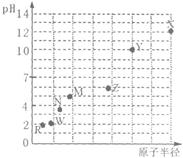
| A.原子序数:W>Z>X |
| B.气态氢化物的稳定性:N>R |
| C.Y和W形成共价化合物 |
| D.X和Z两者最高价氧化物对应的水化物能相互反应 |
几种短周期元素的原子半径及主要化合价见下表,根据表中信息,判断以下说法正确的是
| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.160 | 0.111 | 0.104 | 0.143 | 0.066 |
| 主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
B.离子半径: X2+>T2-
C.元素最高价氧化物对应的水化物的碱性:Y > R >X
D.相同条件下,等物质的量的单质与氢气化合放出能量的多少:T>Z
关于元素周期表的说法正确的是( )
| A.元素周期表有8个主族 | B.元素周期表有7个周期 |
| C.短周期是指第一、二周期 | D.第IA族的元素全部是金属元素 |
同主族元素的原子具有相同的
| A.最外层电子数 | B.核电荷数 |
| C.电子层数 | D.核外电子数 |