题目内容
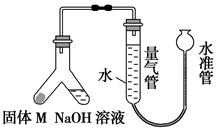
将质量为11.5 g钠和一定量的铝混合放入水中,充分反应共收集到12.32 L气体(标准状况),若反应后溶液的体积为1000 mL,则溶液中所有溶质的物质的量浓度为多少?(写出计算过程)
NaOH:0.3mol/L NaAlO2:0.2 mol/L
解析试题分析:12.32 L气体(标准状况)的物质的量=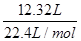 =0.55mol
=0.55mol
11.5g钠的物质的量= =0.5mol
=0.5mol
根据反应的方程式可知
2Na+2H2O=H2↑+2NaOH
2 1 2
0.5mol 0.25mol 0.5mol
这说明铝与氢氧化钠反应生成的氢气物质的量=0.55mol-0.25mol=0.3mol
则根据方程式可知
2Al +2OH-+2H2O=2AlO2-+3H2↑
2 2 2 3
0.2mol 0.2mol 0.2mol 0.3mol
所以反应后氢氧化钠过量,溶液中剩余氢氧化钠的物质的量=0.5mol-0.2mol=0.3mol
NaAlO2的物质的量=0.2 mol/L
考点:考查金属钠和铝的混合物与水的有关判断和计算

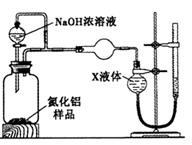
ZnO具有抗菌性,也是重要的轮胎添加剂。工业上由粗ZnO(含FeO、CuO)制备活性ZnO流程如下: 
已知此溶液中Fe2+、Fe3+、Cu2+、Zn2+形成氢氧化物的pH如下表:
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.4 | 3.1 |
| Cu2+ | 5.2 | 6.7 |
| Zn2+ | 6.8 | 9 |
(1)实验室中用98%H2SO4来配制100 mL60%稀硫酸所需使用的玻璃仪器有:烧杯、量筒、 、 、 。
(2)写出在A中加H2O2的离子方程式: 。
(3)向A中可以加入 (写化学式)调节溶液pH范围在 之间;沉淀C为 。
(4)碱式碳酸锌[Zn3(OH)4CO3·H2O]焙烧制备活性ZnO的化学方程式为 。
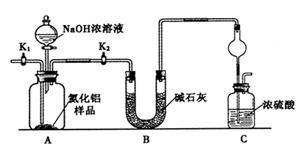
大型钢铁企业酸洗钢材时产生的废液主要成分为Fe2+、H+、Cl-,可用下述方法处理该废液,回收盐酸,制备氧化铁涂料。 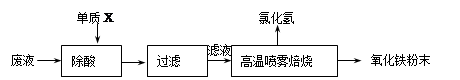
(1)单质X的化学式是 。
(2)氯化亚铁溶液经高温喷雾焙烧时转化为氯化氢气体和氧化铁粉末。有关的化学方程式为:
(3)某种铁红涂料的成分中,除含有Fe2O3外,还添加有CuO或FeO中的一种。请设计实验探究该铁红涂料中添加的物质。
①提出合理假设
假设1:添加了CuO。 假设2:添加了FeO。
②基于假设 (填“1”或“2”),设计实验方案,进行实验。在答题卡上写出实验步骤、预期现象和结论。
限选实验试剂:铁粉、3mol?L-1H2SO4、0.01 mol?L-1酸性KMnO4溶液、10%NaOH溶液、10%H2O2、KSCN溶液
| 操作步骤 | 预期现象和结论 |
| 步骤1.取少量样品于试管中,_________________ ____________________________________________ | ___________________________ |
| 步骤2. ____________________________________________ | ___________________________ |
(4)用水吸收“高温喷雾焙烧”时产生的氯化氢气体可得到盐酸。请计算:用1000g水需吸收标准状况下多少升氯化氢气体可得到36.5%的浓盐酸?(写出计算过程,结果可用数学表达式表示,不必化简)。
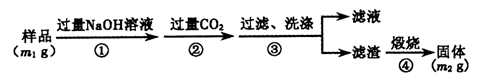
(12分)铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(杂质中不含铁元素,且杂质不与H2、H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定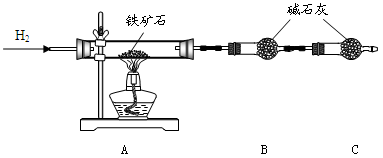
实验结果:将5.0g铁矿石放入硬质玻璃管中完全反应, 测得装置B增重1.35 g。
Ⅱ.铁矿石中含铁量的测定
Ⅲ.问题讨论与解决:
(1)如要验证滤液A中铁元素的存在形式,可另取两份滤液A分别进行实验,实验方法、现象与结论如下表。请将其补充完整。
可供选择的试剂有:酸性KMnO4溶液、NaOH溶液、KSCN溶液、氯水
| 实验方法 | 实验现象 | 结论 |
| 步骤1:在滤液A中加入 | | 滤液A中有Fe3+ |
| 步骤2:在滤液A中加入 | | 滤液A中有Fe2+ |
(3)步骤③中反应的离子方程式为: ;
(4)请通过实验Ⅰ、Ⅱ计算出该铁矿石中铁的氧化物的化学式。(写出计算过程)