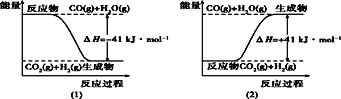
题目内容
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。

(1)加热前通入氮气的目的是_____________,操作方法为____________ 。
(2)装置A、C、D中盛放的试剂分别为A_______,C________,D_______。
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl的含量将_______(填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将________;
(4)若样品质量为wg,反应后C、D增加的质量分别为m1g、m2g,由此可知混合物中Na2CO3·10H2O的质量分数为_______(用含w、m1、m2的代数式表示)
【答案】除去装置中的水蒸气和二氧化碳 关闭b,打开a,缓缓通入氮气,直至a处出来的空气不再使澄清石灰水变浑浊为止 碱石灰 无水CaCl2(或无水硫酸铜、P2O5等) 碱石灰 偏低 无影响 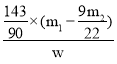 ×100%
×100%
【解析】
将混合物加热会产生H2O(g)、CO2等气体,应在C、D中分别吸收,由干燥剂的性质知应先吸收水,再吸收二氧化碳,且C中的干燥剂吸水后不能吸收CO2;由D的增重(NaHCO3分解产生的CO2的质量)可求出NaHCO3质量.由C的增重(Na2CO310H2O分解产生的H2O及已经知道的NaHCO3分解产生的H2O的质量)可求出Na2CO310H2O的质量,从而求出NaCl的质量;故应在实验前想法赶出装置中的空气;E中碱石灰可防止外界空气中的H2O(g)、CO2进入装置D影响实验效果,据此分析解答。
(1)本实验中需要分别测定反应生成的二氧化碳和水的质量,所以实验前必须将装置中的水蒸气和二氧化碳赶走,避免影响测定结果;操作方法为:关闭b,打开a,缓缓通入空气,直至a处出来的空气不再使澄清石灰水变浑浊为止,故答案为:除去装置中的水蒸气和二氧化碳;关闭b,打开a,缓缓通入空气,直至a处出来的空气不再使澄清石灰水变浑浊为止;
(2)装置A用于吸收空气中的二氧化碳和水,可以使用碱石灰;装置C吸收Na2CO310H2O和NaHCO3分解生成的水蒸气,可以使用无水CaCl2;装置D吸收碳酸氢钠分解生成的二氧化碳,可以用碱石灰,故答案为:碱石灰;无水CaCl2(或无水硫酸铜、P2O5等);碱石灰;
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则m(H2O)增加,使Na2CO310H2O和NaHCO3的含量偏高,NaCl的含量偏低;若B中反应管右侧有水蒸气冷凝,测定碳酸氢钠的质量是根据装置D中质量变化计算的,与水蒸气的量无关,则测定结果中NaHCO3的含量不变,故答案为:偏低;无影响;
(4)若样品质量为wg,反应后C、D增加的质量分别为m1g、m2g,则碳酸氢钠分解生成的二氧化碳的质量为m2g,
2NaHCO3 ![]() Na2CO3+CO2↑ + H2O
Na2CO3+CO2↑ + H2O
44 18
m2g m(H2O)
m(H2O)=![]() =
=![]() g,则Na2CO3·10H2O分解生成的水的质量为m1g-
g,则Na2CO3·10H2O分解生成的水的质量为m1g-![]() g,则Na2CO3·10H2O的质量为
g,则Na2CO3·10H2O的质量为![]() ×(m1g-
×(m1g-![]() g),因此混合物中Na2CO3·10H2O的质量分数为:
g),因此混合物中Na2CO3·10H2O的质量分数为: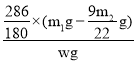 ×100%=
×100%=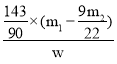 ×100%,故答案为:
×100%,故答案为: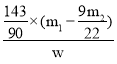 ×100%。
×100%。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
![]()
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
② 固定好滴定管并使滴定管尖嘴充满液体;
③ 调节液面至“0”或“0”刻度线稍下,并记下读数;
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有误的是(填编号)____,若测定结果偏高,其原因可能是______.
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是____________________________。
(3)如下图是某次滴定时的滴定管中的液面,其读数为________mL。
(4)根据下列数据:请计算待测盐酸溶液的浓度______mol/L。
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |