题目内容
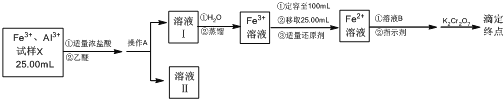
【题目】某工厂以硝酸为原料生产亚硝酸钠,其工艺流程如下:

已知:Na2CO3+NO+NO2===2NaNO2+CO2
(1)“分解塔”中SO2从塔底进入,硝酸从塔顶喷淋,其目的是_____________________________。
(2)“分解塔”中的温度不宜过高,其原因是_____________________________________________。
(3)按一定计量比在“分解塔”中通SO2和喷入硝酸,若反应后生成的NO与NO2物质的量之比恰好1∶1,则“分解塔”中发生反应的化学方程式为______________________________________________。
(4)“分解塔”中的硝酸浓度不宜过大的原因是___________________________________________。
(5)为提高氮氧化物的转化率,可向“尾气”中通入一定量的________气体,再通入“吸收塔”中,实现循环吸收。
(6)“吸收塔”所得溶液中除含有NaNO2、NaNO3和少量Na2CO3外,还含有的溶质为________(填化学式)。
【答案】使SO2气体被充分吸收硝酸受热会挥发、分解2HNO3+2SO2+H2O===NO+NO2+2H2SO4硝酸浓度过大,氮氧化物中NO2含量高,导致亚硝酸钠产率降低(或硝酸钠含量过高)O2NaHCO3
【解析】
(1)“分解塔”中SO2从塔底进入,硝酸从塔顶喷淋,采取逆向吸收,接触更充分,吸收效果更好,故答案为:使SO2气体被充分吸收;
(2)因硝酸不稳定,受热易分解,“分解塔”中的温度不宜过高,故答案为:硝酸受热会挥发、分解;
(3)由题给信息可知反应物为硝酸和二氧化硫,生成物为物质的量之比为1:1的NO与NO2、硫酸等,则反应的方程式为:2HNO3+2SO2+H2O===NO+NO2+2H2SO4,故答案为:2HNO3+2SO2+H2O===NO+NO2+2H2SO4;
(4)浓硝酸的还原产物是NO2,稀硝酸的还原产物是NO,故当硝酸浓度过大,主要还原生成NO2,导致亚硝酸钠产率降低;若硝酸浓度过低,分解塔中出来的主要是NO,亚硝酸钠产率也低;故答案为:硝酸浓度过大,氮氧化物中NO2含量高,导致亚硝酸钠产率降低(或硝酸钠含量过高);
(5)吸收塔中尾气的成分主要是NO和NO2,故可以通入适量的O2,再进入吸收塔,循环吸收,故答案为:O2;
(6)由碳酸钠与酸反应的原理可知“吸收塔”所得溶液中除含有NaNO2、NaNO3和少量Na2CO3外,还含有NaHCO3,故答案为:NaHCO3。