题目内容
已知25℃时,几种物质的溶度积常数为AgCl~1.8×10-10,AgBr~7.7×10-13,AgI~8.51×10-16,下列有关说法错误的是( )
| A、三种物质在常温下溶解度最小的是AgI | B、饱和AgCl溶液中,c(Ag+)≈1.34×10-5mol/L | C、将氯化银置于饱和KI溶液中,固体慢慢会由白色转化为黄色 | D、将浓度均为1×10-6mol/L的AgNO3溶液、KBr溶液等体积混合会生成沉淀 |
分析:A.化学式相似的物质的溶度积常数越小,物质越难溶,溶解度越小;
B.根据溶度积可知c(Ag+)=
;
C.根据化学式相似的物质,溶度积大的沉淀可以转化为溶度积小的沉淀;
D.温度一定时,当溶液中c(Ag+)×c(Br-)>Ksp(AgBr)时,形成沉淀;
B.根据溶度积可知c(Ag+)=
| KSP(AgCl) |
C.根据化学式相似的物质,溶度积大的沉淀可以转化为溶度积小的沉淀;
D.温度一定时,当溶液中c(Ag+)×c(Br-)>Ksp(AgBr)时,形成沉淀;
解答:解:A.化学式相似的物质的溶度积常数越小,物质越难溶,溶解度越小,可知常温下在水中溶解能力AgCl>AgBr>AgI,故A正确;
B.饱和AgCl溶液中,c(Ag+)=
=
mol/L=1.34×10-5mol/L,故B正确;
C.KSP(AgCl)<KSP(AgI),所以将氯化银置于饱和KI溶液中,固体慢慢会由白色转化为黄色,故C错误;
D.浓度均为1×10-6mol/L的AgNO3溶液、KBr溶液等体积混合,c(Ag+)×c(Br-)=0.5×10-6×0.5×10-6
=0.25×10-12<7.7×10-13,所以不会产生沉淀,故D错误;
故选:D;
B.饱和AgCl溶液中,c(Ag+)=
| KSP(AgCl) |
| 1.8×10 -10 |
C.KSP(AgCl)<KSP(AgI),所以将氯化银置于饱和KI溶液中,固体慢慢会由白色转化为黄色,故C错误;
D.浓度均为1×10-6mol/L的AgNO3溶液、KBr溶液等体积混合,c(Ag+)×c(Br-)=0.5×10-6×0.5×10-6
=0.25×10-12<7.7×10-13,所以不会产生沉淀,故D错误;
故选:D;
点评:本题考查学生利用溶度积进行计算,明确沉淀的转化、离子浓度、溶度积与生成沉淀的关系即可解答,题目难度不大.

练习册系列答案
相关题目
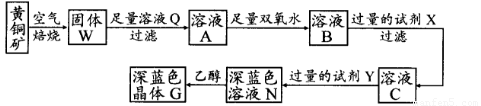
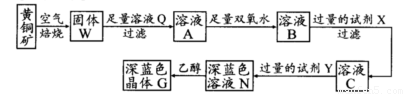
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下:
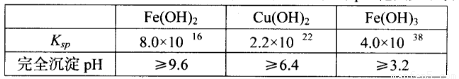
已知25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
|
|
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
|
Ksp |
8.0×10-16 |
2.2×10-22 |
4.0×10-38 |
|
完全沉淀pH |
≥9.6 |
≥6.4 |
≥3.2 |
(1)加快黄铜矿焙烧速率,可采用的措施有 (写两种):
(2)加入双氧水可能发生反应的离子方程式为 ;
试剂X的化学式为 。
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为 ;
用pH试纸测该溶液pH值的方法是
(4)已知Cu(OH)2+4NH3·H2O [Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式:
。
[Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式:
。
(5)在溶液N中加入乙醇的目的是 。