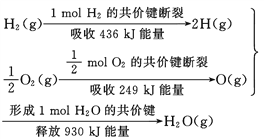
题目内容
【题目】试根据氧化还原反应:2FeCl3+Cu=2FeCl2+CuCl2设计原电池,并画出装置图________________,指出电解质溶液是________________,负极是________________,电极反应式为__________________,正极是___________,电极反应式为____________。
【答案】 FeCl3溶液 Cu Cu-2e-=Cu2+ 石墨 2Fe3++2e-=2Fe2+
FeCl3溶液 Cu Cu-2e-=Cu2+ 石墨 2Fe3++2e-=2Fe2+
【解析】
氧化还原反应中的氧化剂在正极反应,还原剂在负极反应。根据化学方程式可知,铜作负极,FeCl3为电解质,正极选用不与FeCl3反应但能导电的物质,据此进行分析。
反应“Cu+2FeCl3=CuCl2+2FeCl2”可知,反应中铜被氧化,应为原电池负极,失电子而被氧化,电极反应为Cu-2e-=Cu2+;正极应为活泼性比Cu弱的金属或非金属材料,Fe3+在正极得到电子而被还原,电极反应式为2Fe3++2e-=2Fe2+,电解质溶液为FeCl3;铜做负极,石墨做正极,装置图为: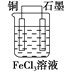 ;
;
故答案是: ;FeCl3溶液;Cu④Cu-2e-=Cu2+;石墨;2Fe3++2e-=2Fe2+。
;FeCl3溶液;Cu④Cu-2e-=Cu2+;石墨;2Fe3++2e-=2Fe2+。
。

 同步奥数系列答案
同步奥数系列答案【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g) ![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
平衡v正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | α1 (SO2) | α2 (SO3) | α3 (SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A. v/span>1<v2,c2< 2c1 B. K1>K3,p2> 2p3
C. v1<v3,α1(SO2) <α3(SO2) D. c2> 2c3,α2(SO3)+α3(SO2)<1
【题目】酸碱中和滴定是中学化学常见实验。
Ⅰ.下图表示50mL酸式滴定管中液面的位置,如果液面处的读数是a,则滴定管中剩余液体的体积是______mL。

A、a B、大于a C、小于(50-a) D、大于(50-a)
Ⅱ.某同学欲测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A 冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。
B 量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C 将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D 将物质的量浓度为1.50 mol·L-1的标准NaOH溶液装入碱式滴定管,调节液面记下读数V1。
E 继续滴定至终点,记下读数为V2。
F 在锥形瓶下垫一张白纸,把锥形瓶移到碱式滴定管下小心滴入NaOH标准溶液,边滴边摇动锥形瓶。
G 量取浓硫酸样品5 mL,在烧杯中用蒸馏水溶解。
H 重复以上实验。
请回答下列问题:
(1)该实验正确操作步骤的顺序为____→ A →_____→_____→D→_____→_____→ H(用编号字母填写)。
(2)量取5mL浓硫酸的仪器是________________________;量取20.00mL稀硫酸的仪器是_________。
(3)选用的指示剂是_____________。滴定过程中,视线应注视____________________;判断到达滴定终点的现象是________________;读数时,视线应____________(填“高于”、“低于”或“相平于”)溶液凹液面的最低处。
(4)下表是实验测得的有关数据:
滴定序号 | 待测稀硫酸的体积(mL) | 所消耗NaOH标准溶液液的体积(mL) | |
V1 | V2 | ||
① | 20.00 | 0.50 | 22.60 |
② | 20.00 | 6.00 | 27.90 |
请计算出该浓硫酸样品的浓度为____________mol·L-1 (不必写出计算过程)。
【题目】目前我国研制的稀土催化剂催化转化汽车尾气示意图如下:

(1)Zr原子序数为40,价电子排布式为4d25s2,它在周期表中的位置是_______________。
(2)图中互为等电子体的两种气体分子是_____________。
(3)C3H8中所有碳原子的杂化方式是___________。
(4)图中属于非极性的气体分子是_______________________。
Fe、Mn元素的部分电离能数据列于下表中
元素 | Fe | Mn | |
电离能(kJ·mol-1) | I1 | 759 | 717 |
I2 | 1561 | 1509 | |
I3 | 2957 | 3248 | |
(5)从上表两元素部分电离能数据比较的可知,气态Mn2+再失去一下电子比气态Fe2+再夫去一个电子难,原因是_____________。
(6)CO与Ni可生成羰基镍[Ni(CO)4],已知其中镍的化合价为0,镍原子在基态时核外电子排式为_____________,[Ni(CO)4]的配体是_________,配位原子是__________。
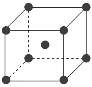
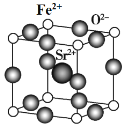
(7)为了节省贵金属并降低成本,也常用钙钛矿型复合氧化物作为催化剂。一种复合氧化物结构如图所示,则与每个Sr2+紧邻的O2-有______个。
(8)与Zr相邻的41号元素Nb金属的晶格类型为体心立方晶格,原子半径为apm,相对原子质量为b,阿伏加德罗常数为NA,试计算晶体铌的密度为______________g·cm-3(用来a、b、NA表示计算结果)。