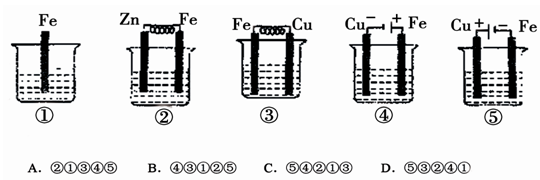
题目内容
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为,3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH下列叙述不正确的是
3Zn(OH)2 + 2Fe(OH)3 + 4KOH下列叙述不正确的是
| A.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化 |
| B.放电时负极反应为:Zn—2e— +2OH—= Zn(OH)2 |
C.充电时阳极反应为:Fe(OH)3 —3e— + 5 OH— = FeO + 4H2O + 4H2O |
| D.放电时正极附近溶液的碱性增强 |
A
解析试题分析:原电池放电时,正极发生还原反应,直接判断A错误,电池的负极反应式为:3Zn—6e— +6OH—="3" Zn(OH)2;正极反应式为2FeO + 8H2O+6e—=" 2" Fe(OH)3+10 OH—;充电时电池正极为阳极发生氧化反应。由正极反应式知放电时正极附近碱性增强。
+ 8H2O+6e—=" 2" Fe(OH)3+10 OH—;充电时电池正极为阳极发生氧化反应。由正极反应式知放电时正极附近碱性增强。
考点:原电池原理。

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
氢镍电池是一种碱性可充电电池,污染小,比能量较大。氢镍电池的总反应式是:
H2+2NiO(OH)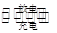 2Ni(OH)2。据此反应式判断,下列叙述中正确的是
2Ni(OH)2。据此反应式判断,下列叙述中正确的是
| A.电池放电时,H2是正极 |
| B.电池充电时,镍元素被还原 |
| C.充电时,电池负极的电极反应式为2H2O+2e—=H2+2OH— |
| D.电池放电时,H2是负极,负极周围溶液的pH不断增大 |
如图装置中,在U形管底部盛有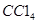 ,分别在U形管两端小心倒入饱和食盐水和饱和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述错误的是
,分别在U形管两端小心倒入饱和食盐水和饱和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述错误的是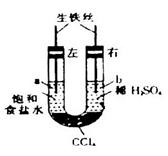
A.铁丝在两处的腐蚀速率: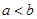 |
B.a、b两处相同的电极反应式为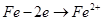 |
| C.一段时间后,a处液面高于b处液面 |
| D.生铁丝中的碳在a、b两处分别作原电池的负极和正极 |
关于右图电化学装置中的电极名称、材料及反应均可能正确的是 ( )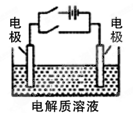
| A.阴极(Cu片)2C1――2e-=Cl2↑ |
| B.阳极(Cu片):4OH――4e-=2H2O+O2↑ |
| C.正极(石墨棒):Fe3+ +e-= Fe2+ |
| D.负极(Fe钉):Fe-3e-=Fe3+ |
镁—H2O2酸性燃料电池采用海水作电解质(加入一定量的酸),下列说法正确的是
| A.电池总反应为Mg+H2O2 = Mg(OH)2 |
| B.正极发生的电极反应为H2O2+2H++2e- = 2H2O |
| C.工作时,正极周围海水的pH减小 |
| D.电池工作时,溶液中的H+向负极移动 |
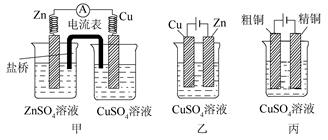
某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4==2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是
| A.乙烧杯中发生还原反应 |
| B.甲烧杯中溶液的pH逐渐减小 |
| C.电池工作时,盐桥中的SO42-移向甲烧杯 |
| D.外电路的电流方向是从a到b |
甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能。乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水。下列说法中不正确的是 ( )。
| A.装置乙的a极要与装置甲的X极连接 |
| B.装置乙中b极的电极反应式为2Cl--2e-=Cl2↑ |
| C.若有机废水中主要含有葡萄糖,则装置甲中M极发生的电极应为C6H12O6+6H2O-24e-=6CO2↑+24H+ |
| D.N电极发生还原反应,当N电极消耗5.6 L(标准状况下)气体时,则有2NA |