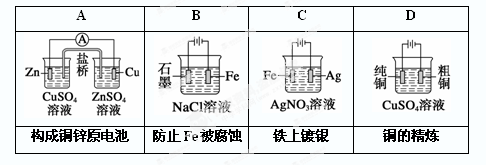
题目内容
镁—H2O2酸性燃料电池采用海水作电解质(加入一定量的酸),下列说法正确的是
| A.电池总反应为Mg+H2O2 = Mg(OH)2 |
| B.正极发生的电极反应为H2O2+2H++2e- = 2H2O |
| C.工作时,正极周围海水的pH减小 |
| D.电池工作时,溶液中的H+向负极移动 |
B
解析试题分析:据据物质的性质判断原电池的正负极,正确书写电极反应式为解答该题的关键;镁—H2O2酸性燃料电池中,活泼金属Mg失去电子被氧化,应为原电池的负极,电极反应式为Mg-2e-=Mg2+, H2O2得电子被还原,生成H2O,正极电极反应式为H2O2+2e-+2H+=2H2O,则电池总反应为Mg+H2O2+2H+=Mg2++2H2O,根据电极反应式和总反应式判断溶液离子浓度的变化;A、根据上述分析知,电池总反应式为Mg+H2O2+2H+=Mg2++2H2O,错误;B、H2O2得电子被还原,生成H2O,正极电极反应式为H2O2+2H++2e- = 2H2O,正确;C、工作时,正极电极反应式为H2O2+2e-+2H+=2H2O,消耗H+,则pH增大,错误;D、电池工作时,溶液中的H+向正极移动,错误。
考点:考查原电池原理及电极反应式的书写。

高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为,3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH下列叙述不正确的是
3Zn(OH)2 + 2Fe(OH)3 + 4KOH下列叙述不正确的是
| A.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化 |
| B.放电时负极反应为:Zn—2e— +2OH—= Zn(OH)2 |
C.充电时阳极反应为:Fe(OH)3 —3e— + 5 OH— = FeO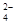 + 4H2O + 4H2O |
| D.放电时正极附近溶液的碱性增强 |
如图用石墨作电极的电解池中,放入某足量蓝色溶液500mL进行电解,观察到A电极表面有红色固体生成,B电极有无色气体生成;通电一段时间后,取出A电极,洗涤、干燥、称量,A电极增重1.6g。下列说法错误的是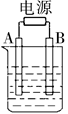
| A.图中B极同电源正极相连 |
| B.该蓝色溶液可能是Cu(NO3)2或CuCl2溶液[ |
| C.电解后溶液的pH约为 1(溶液体积变化忽略不计) |
| D.要使电解后溶液恢复到电解前的状态,则可加入2 g CuO |
某污水中含有Fe3+、Ag+、Cu2+等离子,某工厂采用电解的方法处理该污水,具体的做法是:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3。Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用,阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。该厂污水处理设计装置如图所示,下列说法正确的是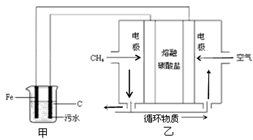
| A.为了增加污水的导电能力,可向污水中如入适量的Na2SO4固体 |
| B.甲装置中Fe电极的反应为Fe-3e-=Fe3+ |
| C.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环物质为H2O |
| D.当乙装置中有1.6gCH4参加反应,则C电极理论上生成气体在标准状况下为8.96L |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为
2CH3OH + 3O2 + 4OH-  2CO32- + 6H2O, 则下列说法中正确的是
2CO32- + 6H2O, 则下列说法中正确的是
| A.充电时有CH3OH生成的电极为阳极 |
| B.充电时每生成1 mol CH3OH转移12mol电子 |
| C.放电时电解质溶液的pH逐渐增大 |
| D.放电时负极的电极反应为:CH3OH-6e-+8OH-= CO32-+ 6H2O |
如图为铁片上镀铜的实验装置,下列说法正确的是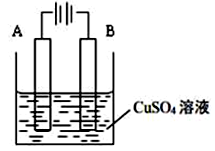
| A.Cu2+在A极被还原 |
| B.硫酸铜溶液浓度变小 |
| C.铜片连接电源正极,铁片上发生还原反应 |
| D.B极发生反应:Cu-2e-=Cu2+ |
下图是水煤气(成分为CO、H2)、空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中正确的是
| A.A处通入的是空气,B处通入的是水煤气 |
| B.a电极发生还原反应,b电极发生氧化反应 |
| C.如用这种电池电镀铜,待镀金属增重6.4 g,则至少消耗标准状况下的水煤气2.24 L |
| D.a电极的反应式包括:CO+4OH-+2e-=CO32-+2H2O |
一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液。下列说法中不正确的是( )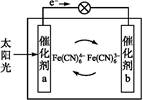
| A.K+移向催化剂b |
B.催化剂a表面发生的化学反应:Fe(CN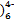 -e- -e- Fe(CN Fe(CN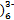 |
C.Fe(CN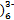 在催化剂b表面被氧化 在催化剂b表面被氧化 |
D.电解质溶液中的Fe(CN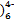 和Fe(CN 和Fe(CN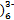 浓度基本保持不变 浓度基本保持不变 |