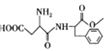
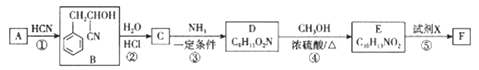
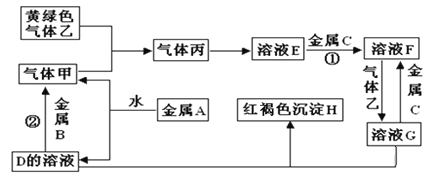
��Ŀ����
����Ŀ��2015������������������Ű�ҹ��ж�����������������β������ɿ�����Ⱦ����Ҫԭ������β����������Ҫԭ��Ϊ��
2NO��g��+2CO��g�� ![]() 2CO2��g��+N2��g�������ܱ������з����÷�Ӧʱ��c��CO2�����¶ȣ�T���������ı������S����ʱ�䣨t���ı仯������ͼ1��ʾ��
2CO2��g��+N2��g�������ܱ������з����÷�Ӧʱ��c��CO2�����¶ȣ�T���������ı������S����ʱ�䣨t���ı仯������ͼ1��ʾ��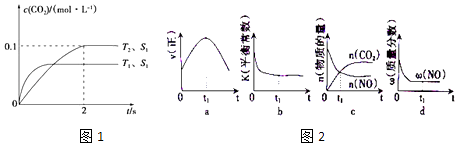
��1���÷�Ӧ�ġ�H0��ѡ�����������������
��2����T2�¶��£�0��2s�ڵ�ƽ����Ӧ����v��N2��= ��
��3�����������������һ��ʱ����������漴�����ѧ��Ӧ���ʣ��������ı����S1��S2 �� ��ͼ1�л���c��CO2����T1��S2�����´ﵽƽ������еı仯���ߣ�
��4�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�ͼ2��ʾ��ͼ��ȷ����˵����Ӧ��t1ʱ�̴��ڻ�ѧƽ��״̬����������ţ���
���𰸡�
��1����
��2��0.025mol/��L?s��
��3��
��4��bd
���������⣺��1�����ݡ��ȹ���ƽ��ֵ��֪��T1��T2�������¶ȶ�����̼�������ͣ�˵��ƽ�������ƶ��������¶�ƽ�������ȷ����ƶ�����������Ӧ�Ƿ��ȷ�Ӧ����H��0��
�ʴ�Ϊ������
��2����T2�¶��£�0��2s�ڣ���c��CO2��=��0.1��0��mol/L=0.1mol/L�����ݷ���ʽ֪����c��N2��= ![]() ��c��CO2����v��N2��=
��c��CO2����v��N2��= ![]() =
= ![]() =0.025mol/��Ls����
=0.025mol/��Ls����
�ʴ�Ϊ��0.025mol/��Ls����
��3�������Ӵ����Խ��Ӧ����Խ�죬�����̷�Ӧ�ﵽƽ���ʱ�䣬��������̼ת���ʲ��䣬������ͼ��Ϊ  ���ʴ�Ϊ��
���ʴ�Ϊ��  ��
��
��4��a������ƽ���������������ȣ����ٱ仯��t1ʱ��V�����֮���淴Ӧ�������ʷ����仯��δ����ƽ�⣬��a����
b���÷�Ӧ����ӦΪ���ȷ�Ӧ���淴Ӧ�����¶����ߣ���ѧƽ�ⳣ����С������ƽ����¶�Ϊ��ֵ������ߣ�ƽ�ⳣ�����䣬Ϊ��С��ͼ����ʵ�ʷ��ϣ���b��ȷ��
c��t1ʱ�̺������̼��NO�����ʵ��������仯��t1ʱ��δ����ƽ��״̬����c����
d��NO����������Ϊ��ֵ��t1ʱ�̴���ƽ��״̬����d��ȷ��
�ʴ�Ϊ��bd��
��1�������¶ȶԻ�ѧƽ���Ӱ������ʱ䣻
��2�����ݻ�ѧ��Ӧ���ʵĶ������2s�ڵķ�Ӧ���ʣ�
��3������ֻ�ܸı䷴Ӧ���ʣ������ܸı仯ѧƽ�⣻
��4�����ݿ��淴Ӧ�ﵽƽ��״̬����ֵİٷֺ������䡢���淴Ӧ������Ƚ����жϼ���.

 �ƸԹھ��ο���ϵ�д�
�ƸԹھ��ο���ϵ�д�