题目内容
【题目】下表是元素周期表的一部分,回答下列有关问题:

(1)写出下列元素名称:②_________;___________。
(2)在这些元素中,金属性最强的元素是______(用元素符号表示),元素⑨与元素⑩相比,非金属性较强的是___________(用元素符号表示)。下列表述中能证明这一事实的是______________。
a.常温下⑨的单质和⑩的单质状态不同
b. ⑩的氢化物比⑨的氢化物稳定
c.一定条件下⑨和⑩的单质都能与氢氧化钠溶液反应
(3)⑦的最高价氧化物对应水化物与⑩的最高价氧化物对应水化物反应的离子方程式为:______。
(4)②的气态氢化物与HC1在空气中相遇有白烟生成,写出白烟对应物质的电子式_________。
【答案】 氮 氩 K Cl b Al(OH)3+3H+=Al3++3H2O 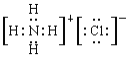
【解析】首先根据元素在周期表中的相对位置判断出元素名称,然后结合元素周期律以及相关物质的性质分析解答。
根据元素在周期表中的相对位置可知①~分别是C、N、O、F、Na、Mg、Al、Si、S、Cl、Ar、K、Ca。则
(1)根据以上分析可知②、的元素名称分别是氮、氩。
(2)同周期自左向右金属性逐渐减弱,同主族从上到下金属性逐渐增强,则在这些元素中,金属性最强的元素是K;同周期自左向右非金属性逐渐增强,则元素⑨与元素⑩相比,非金属性较强的是Cl。a.非金属性强弱与其单质的状态没有关系,a错误;b.非金属性越强,氢化物越稳定,则⑩的氢化物比⑨的氢化物稳定说明氯元素的非金属性强于硫元素,b正确;c.一定条件下⑨和⑩的单质都能与氢氧化钠溶液反应不能说明二者的非金属性强弱,c错误。答案选b;
(3)⑦的最高价氧化物对应水化物氢氧化铝与⑩的最高价氧化物对应水化物高氯酸反应的离子方程式为Al(OH)3+3H+=Al3++3H2O;
(4)②的气态氢化物氨气与HC1在空气中相遇有白烟生成,生成物是氯化铵,含有离子键的离子化合物,电子式为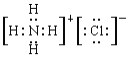 。
。

 阅读快车系列答案
阅读快车系列答案【题目】温度为T时,在4.0L恒容密闭容器中充入2.0mol PCl5 , 发生反应:PCl5(g)PCl3(g)+Cl2(g),反应时间(t)与容器内气体总压强(p)的数据见表:
t/s | 0 | 50 | 150 | 250 | 350 |
总压强p/100kPa | 100 | 116 | 119 | 120 | 120 |
(1)由总压强p和起始压强p0计算反应物PCl5的转化率α(PCl5)的表达式为?平衡时PCl5的转化率为多少?
(2)反应在前50s的平均速率v(PCl3)为多少?
(3)该温度下的平衡常数为多少?