题目内容
(16 分)
为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究。
(1) ①把含有较高浓度CO2的空气通入饱和K2CO3溶液。
②在①的吸收液中通高温水蒸气得到高浓度的CO2气体。
写出②中反应的化学方程式________________________。
(2) 如将CO2与札以1:3的体积比混合。
①适当条件下合成某烃和水,该烃是________(填序号)。
A.烷烃 B.烯烃 C.炔烃 D,苯的同系物
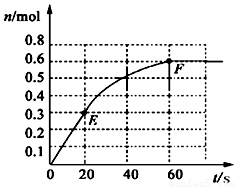
②适当条件下合成燃料甲醇和水。在体积为2L的密闭容器中,充人2 mol CO2和6 mol H2,一定条件下发生反应:.
O
测得CO2(g)和CH3OH(S)的浓度随时间变化如图所示。
从反应开始到平衡,V(H2) =________氢气的转化率=________;能使平衡体系中4CH3OH)/n(CO2)增大的措施有________。
(3) 如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
巳知
写出C02(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式________________。
(4) 某同学用沉淀法测定含有较髙浓度CO2的空气中CO2的含量,经査得一些物质在200C的数据如下表。
(说明:越小,表示该物质在水中越易沉淀)
吸收CO2最合适的试剂是________[填"Ca(OH)3"或“Ba(OH)2"]溶液,实验时除需要测定工业废气的体积(折算成标准状况)外,还需要测定________。
(16分)
解析:

(16分)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上常用CO和H2反应生产CH3OH,并开发出甲醇燃料电池。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=-283.0 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1453.0 kJ·mol-1
则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为 。
(2)工业上常利用反应CO(g)+2H2(g)≒CH3OH(g) △H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图。
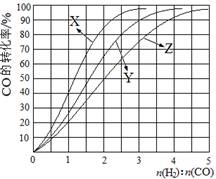
|
A.1~1.5 B.2.5~3 C.3.5~4.5
(3)制甲醇所需要的氢气,可用下列反应制取:H2O(g)+CO(g) H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
①该温度下,若起始时c(CO)=1 mol·L-1,c(H2O)=2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应v(正) v(逆)(填“>”、“<”或“=”)。
②若降低温度,该反应的K值将 (填“增大”、“减 小”或“不变”)。
(4)某实验小组设计了如图所示的甲醇燃料电池装置。
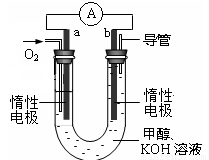
①该电池工作时,OH-向 极移动(填“a”或“b”)。
②工作一段时间后,测得溶液的pH减小,该电池负极反应式为 , 电池总反应的离子方程式为 。
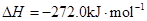
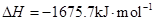

 Na2S(s)
+ 4H2O(g) 。
Na2S(s)
+ 4H2O(g) 。
 Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)=0.04 mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。
Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)=0.04 mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。 PCl5 (g)
PCl3(g) + Cl2 (g)。其中物质PCl3的物质的量变化如图所示。
PCl5 (g)
PCl3(g) + Cl2 (g)。其中物质PCl3的物质的量变化如图所示。