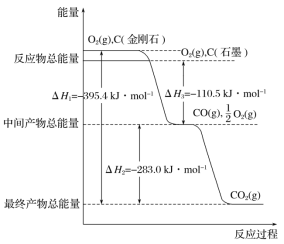
题目内容
【题目】根据下图回答下列问题。
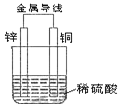
(1)该原电池外电路中电流方向:锌_________铜(填“→”或“←”)。
(2)该原电池中_________电极(写出电极材料名称)产生无色气泡,写出该电极反应式:________;该电极发生 ______________反应(填“氧化”或“还原”)。当电路中通过0.2mol电子时,该电极上产生的气体在标准状况下的体积为_________L。
(3)一段时间后,烧杯中溶液的pH_____________(填“增大”或“减小”)。
【答案】← 铜 2H++2e-=H2↑ 还原 2.24L 增大
【解析】
(1)该原电池中,锌和铜作两极,锌比铜活泼,所以锌作负极,铜作正极,电流从正极流向负极,故答案为←;
(2)该电池中氢离子在正极得电子生成H2,发生还原反应:2H++2e-=H2↑。当电路中通过0.2mol电子时,生成氢气0.1mol,在标准状况下体积为2.24L。故答案为:铜,2H++2e-=H2↑,还原,2.24L;
(3)由于氢离子得电子变成氢气,使氢离子浓度降低,故溶液pH变大,所以填“增大”。

【题目】用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0.7克镁带,按右图连接好装置,从A中加入20.0mL 0.5mol/LH2SO4。记录注射器活塞的位置和相应的时间。记录数据如下:

时间/s | 0 | t | 2t | ...... |
活塞的位置/mL | 17.3 | 25.6 | 36.6 | ...... |
(1)检查该装置气密性的方法是 ___________________。
(2)仪器A的名称是__________________________。
(3)0-t时间段与t-2t时间段,化学反应速率最快的是_______,原因是______________。
(4)用上述装置探究Fe3+、Cu2+对双氧水分解速率的影响,所用试剂:5%H2O2、0.1mol/LFeCl3、0.2mol/LCuCl2,完成下表的实验设计:
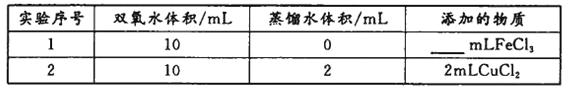
①上表中需要添加的物质是_________mL FeCl3溶液。
②本实验需要测定的数据是____________________________。
(5)为确定MnO2催化双氧水分解的最佳条件,用该实验装置进行实验,反应物用量和反应停止的时间数据如下表。
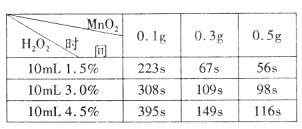
分析表中数据回答下列问题:
①相同浓度的过氧化氢的分解速率随着MnO2用量的增加而_______(填“加快”、“减慢”或“不变”)。
②从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入__________ g的MnO2为较佳选择。
③该小组的某同学分析上述数据后认为:“当用相同质量的MnO2时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确?______(填“正确”或“不正确”),理由是_____________。(提示:H2O2溶液的密度可认为近似相等。)
(6)50mL0.50 mol·L-1的盐酸与50mL0.55 mol·L-1的NaOH溶液在如图所示的装置中进行中和反应。

请回答下列问题:从实验装置上看,图中尚缺少的一种玻璃仪器是____________________,烧杯间填满碎泡沫塑料的作用是____________________________________。大烧杯上如不盖硬纸板,则求得的中和热数值____________(填“偏大” “偏小”或“无影响”)。
(7)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.2 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.3 | 20.5 | 25.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=__________(结果保留一位小数)。