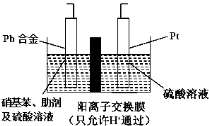
题目内容
【题目】化肥的合理利用显示了化学在促进农业现代化进程中的重要作用。下列化肥既属于氮肥又属于钾肥的是
A. 草木灰 B. 尿素 C. 硝酸钾 D. 氨水
【答案】C
【解析】A、草木灰K2CO3中含有钾元素,只属于钾肥,A错误;B、尿素CO(NH2)2中含有氮元素,只属于氮肥,不属于钾肥,B错误;C、K2NO3中含有钾元素、氮元素,属于钾肥,也属于氮肥,C正确;D、氨水中含有氮元素,属于氮肥,不属于钾肥,D错误。答案选C。

【题目】氯离子插层镁铝水滑石[Mg2Al(OH)6Cl·xH2O]是一种新型离子交换材料,其在高温下完全分解为MgO、Al2O3、HCl和水蒸气。现用下图装置进行实验确定其化学式(固定装置略去)。
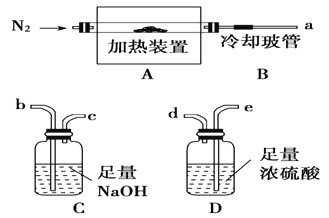
(1)Mg2Al(OH)6Cl·xH2O热分解的化学方程式___________________________。
(2)若只通过测定装置C、D的增重来确定x,则装置的连接顺序为________(按气流方向,用接口字母表示),其中C的作用是________。装置连接后,首先要进行的操作的名称是________。
(3)加热前先通N2排尽装置中的空气,称取C、D的初始质量后,再持续通入N2的作用是______________________、_________________等。
(4)完全分解后测得C增重3.65 g、D增重9.90 g,则x=________。若取消冷却玻管B后进行实验,测定的x值将________(填“偏高”或“偏低”)。
(5)上述水滑石在空气中放置时易发生反应生成[Mg2Al(OH)6Cl1-2y·(CO3)y·zH2O],该生成物能发生类似的热分解反应。现以此物质为样品,用(2)中连接的装置和试剂进行实验测定z,除测定D的增重外,至少还需测定___________。
【答案】 2[Mg2Al(OH)6Cl·xH2O==4MgO+Al2O3+2HCl↑+(5+2x)H2O↑ aedb 吸收HCl气体 检查气密性 将分解产生的气体全部带入装置C、D中完全吸收 防止产生倒吸 3 偏低 装置C的增重及样品质量(样品质量及样品分解后残余物质量或装置C的增重及样品分解后残余物质量)
【解析】(1)从题目可以知道,[Mg2Al(OH)6Cl·xH2O]在高温下完全分解为MgO+Al2O3+HCl和水蒸气,分解产物已经确定,配平即可得到化学方程式。
(2)x是结晶水的系数,确定x需要测定分解产物中水蒸气的质量及![]() 气体的质量,则需先用浓硫酸来吸收尾气中的水蒸气,然后NaOH吸收HCl,通过浓硫酸的增重来计算水蒸气,再通过NaOH溶液的增重来计算HCl,且顺序不能颠倒,因为尾气先经NaOH溶液会带出部分水蒸气,造成较大误差,故连接顺序为aedb;NaOH与酸性气体HCl发生反应,故C的作用是吸收HCl气体;这个反应有大量气体生成,实验前必须检查实验装置的气密性,故首先要进行的操作的名称是检查气密性。
气体的质量,则需先用浓硫酸来吸收尾气中的水蒸气,然后NaOH吸收HCl,通过浓硫酸的增重来计算水蒸气,再通过NaOH溶液的增重来计算HCl,且顺序不能颠倒,因为尾气先经NaOH溶液会带出部分水蒸气,造成较大误差,故连接顺序为aedb;NaOH与酸性气体HCl发生反应,故C的作用是吸收HCl气体;这个反应有大量气体生成,实验前必须检查实验装置的气密性,故首先要进行的操作的名称是检查气密性。
(3)N2不会与体系的任一物质发生反应,故持续通入N2能把分解的气体全部带入装置C、D,另外,反应中产生的气体都被吸收,容易造成倒吸,持续通入![]() 能防止产生倒吸。
能防止产生倒吸。
(4)由化学方程式可知水蒸气和HCl气体的比例关系为: ![]() ,故x=3;若取消冷却玻管B后进行实验,温度过高的水蒸气会影响装置D浓硫酸的吸收,由比例关系式:
,故x=3;若取消冷却玻管B后进行实验,温度过高的水蒸气会影响装置D浓硫酸的吸收,由比例关系式: ![]() 可知,x的值会偏低。
可知,x的值会偏低。
(5)[Mg2Al(OH)6Cl1-2y·(CO3)y·zH2O]与[Mg2Al(OH)6Cl·xH2O]的高温分解反应类似,但还有无法用上述装置测量的H2,故除了装置D的增重,还需测量另外两个变化量,如测量样品质量、样品分解后残余物质量和装置C的增重,故还需测量装置C的增重及样品质量(样品质量及样品分解后残余物质量或装置C的增重及样品分解后残余物质量)。
点睛:实验的所有的设计和操作都是围绕实验目的进行的。测量分解产物的质量,就要尽可能减少误差,所以(3)充入氮气的目的是把生成的气体全部带入后面装置被吸收而减小误差,且可以防止倒吸。
【题型】实验题
【结束】
9
【题目】雾霾天气频繁出现,严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断试样的pH=_________。
(2)汽车尾气中NOx和CO的生成:
①已知汽缸中生成NO的反应为:N2(g)+O2(g)![]() 2NO(g) △H>0恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
2NO(g) △H>0恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
A.混合气体的密度不再变化 B.混合气体的平均分子量不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2 D.氧气的百分含量不再变化
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g),已知该反应的△H>0,则该设想能否实现______________(填“能”或“不能”)
(3)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:
H2(g)+ 1/2O2(g) =H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g) =CO(g)△H =-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:___________________。
②洗涤含SO2的烟气。
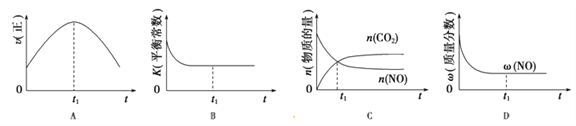
(4)汽车尾气净化的主要原理:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g);△H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_________(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
2CO2(g)+N2(g);△H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_________(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”之一。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质)。一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度/℃ | 活性炭 | NO | E | F |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
(1)写出NO与活性炭反应的化学方程式______________________;
(2)计算上述反应T1℃时的平衡常数K1=__________________;若T1<T2,则该反应的△H__________________0(填“>”、“<”或“=”)。
(3)上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为________;
【题目】通常人们把拆开1 mol某化学键吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热。下列是一些化学键的键能。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol | 414 | 489 | 565 | 155 |
根据键能数据估算反应CH4+4F2=CF4+4HF每消耗1mol CH4的热效应( )
A. 放热1940 kJ B. 吸热1940 kJ C. 放热485 kJ D. 吸热485 kJ