题目内容
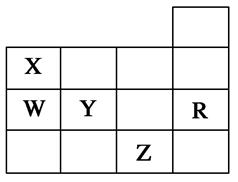
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是

| A.离子半径的大小顺序为:r(W2—)>r(Q—)>r(Y2—)> r(Z3+) |
| B.若存在简单阴离子R2-,则R不一定与Y、W同主族 |
| C.元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键 |
| D.X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应 |
B
试题分析:根据图中各元素在元素周期表中的位置,可推出X为N元素、Y为O元素、Z为Al元素、W为S元素、Q为Cl元素。A、具有相同电子排布的离子,离子半径随原子序数的增加而减小,所以S2?>Cl?>O2?>Al3+,正确;B、若存在简单阴离子R2-,则R最外层电子为6,与Y、W一定同主族,错误;C、元素X的氢化物为NH3,Q的氢化物为HCl,二者化合生成NH4Cl,既含离子键又含共价键,正确;D、X、Z、W、Q四种元素的最高价氧化物对应水化物分别为:HNO3、Al(OH)3、H2SO4、HClO4,都能与强碱反应,正确。

练习册系列答案
相关题目


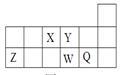
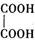 ,草酸钠晶体中存在 (填图中元素代号)。
,草酸钠晶体中存在 (填图中元素代号)。