题目内容
15.元素在周期表中的位置,反映了元素的原子结构和元素的性质,如图是元素周期表的一部分.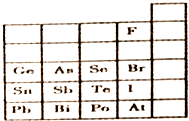
(1)根据元素周期律预测:酸性强弱 H3AsO4<H3PO4.(用“>”或“<”表示)
(2)元素Se的最高正价和最低负价的代数和为4,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度小.(选填“大”、“小”或“相同”)
(3)I2具有较强的氧化性,SO2具有较强的还原性,将适量SO2气体通入碘水后,溶液中主要存在的离子是H+、I-、SO42-.
(4)下列说法正确的是ABD(填序号)
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱.
分析 (1)同主族自上而下,非金属性减弱,非金属性越强,最高价含氧酸的酸性越弱;
(2)最高正化合价=族序数,最低负化合价=族序数-8;元素的非金属性越小,单质的氧化性越弱,与H2反应限度越小;
(3)I2具有较强的氧化性,SO2具有较强的还原性,将适量SO2气体通入碘水后,发生反应:SO2+I2+2H2O=H2SO4+2HI;
(4)A.同周期自左而右原子半径减小;
B.同周期自左而右元素非金属性增强;
C.干冰升华、液态水转变为气态属于物理变化,不需要破坏化学键;
D.元素非金属性越强,对应氢化物越稳定.
解答 解:(1)同主族从上到下非金属性减弱,则最高价含氧酸的酸性越弱,则酸性H3AsO4<H3PO4,
故答案为:<;
(2)Se元素处于ⅥA族,其最高正价=族序数=+6,最低负价=族序数-8=6-8=-2,故元素Se的最高正价和最低负价的代数和为:+6+(-2)=4,元素的非金属性越小,单质的氧化性越弱,与H2反应限度越小,非金属性S>Se,在相同条件下Se与H2反应的限度比S与H2反应限度小,
故答案为:4;小;
(3)I2具有较强的氧化性,SO2具有较强的还原性,将适量SO2气体通入碘水后,发生反应:SO2+I2+2H2O=H2SO4+2HI,离子方程式为SO2+I2+2H2O═4H++2I-+SO42-,则溶液中存在的主要离子是H+、I-、SO42-,
故答案为:H+、I-、SO42-;
(4)A.同周期自左而右原子半径减小,故原子半径:C>N>O>F,故A正确;
B.同周期自左而右元素非金属性增强,故非金属性:Si<P<S<Cl,故B正确;
C.干冰升华、液态水转变为气态属于物理变化,前者破坏分子间作用力,后者破坏氢键、分子间作用力,不需要破坏化学键,故C错误;
D.非金属性F>Cl>Br>I,元素非金属性越强,对应氢化物越稳定,故HF、HCl、HBr、HI的热稳定性依次减弱,故D正确,
故选:ABD.
点评 本题考查元素周期表与元素周期律应用,侧重对元素周期律的考查,难度不大,注意对基础知识的理解掌握.

 阅读快车系列答案
阅读快车系列答案①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
下列说法不正确的是( )
| A. | 反应①②均为放热反应 | |
| B. | 反应①②转移的电子数相同 | |
| C. | 若用标准状况下4.48L CH4还原NO2至N2,放出的热量是173.4kJ | |
| D. | 由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H=-akJ•mol-1,a<574 |
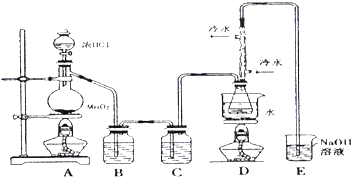 S2Cl2是工业上常用的硫化剂,可以改变生橡胶受热发粘、遇冷变硬的性质.
S2Cl2是工业上常用的硫化剂,可以改变生橡胶受热发粘、遇冷变硬的性质.已知:①S2Cl2易与水反应;②300℃以上完全分解;③微热的情况下S2Cl2能被过量Cl2氧化S2Cl2+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$ 2SCl2;④有关物质的熔沸点如下:
| 物质 | 沸点/℃ | 熔点/℃ |
| S | 445 | 113 |
| CS2 | 47 | -109 |
| CCl4 | 77 | -23 |
| S2Cl2 | 137 | -77 |
①CS2+3C12$\frac{\underline{\;95-100℃\;}}{\;}$CC14+S2Cl2; ②2S+Cl2$\frac{\underline{\;111-140℃\;}}{\;}$S2Cl2.
(1)若实验室选择如图装置(部分夹持装置已略去)来制备S2Cl2,其反应原理是上述中的①(填写序号);上图中尾气处理装置不够完善,改进后的装置应起到的作用是:在D、E之间再加一个干燥装置,同时要能吸收尾气、防倒吸.利用改进后的正确装置进行实验,请回答以下问题
(2)为了提高产品S2Cl2的纯度,实验操作的关键是控制好温度和控制浓盐酸的滴速不能太快.
(3)该实验的操作顺序为:①③②⑤④(用序号表示).
①点燃酒精灯A ②点燃酒精灯D ③通冷凝水 ④熄灭酒精灯A ⑤熄灭酒精灯D
(4)D装置中冲凝管的作用是:冷凝回流、导气;反应结束后,从D装置锥形瓶内的混合物中分离出产物的方法是:蒸馏;某同学取少量产物,小心加入适量水中,观察到有白雾,黄色沉淀、产生的无色气体能使品红
溶液褪色,该同学据此判断.上述实验确有S2Cl2生成,写出S2Cl2与水反应的化学方程式:2S2Cl2+2H2O=S↓+SO2↑+4HCl
(5)S2Cl2中每个原子的最外层都具有8电子结构,请写出S2Cl2的电子式:
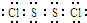 .
. | A. | 粗盐过滤时,用玻璃棒搅拌加快过滤的速度 | |
| B. | 蒸发滤液时,待蒸发皿中滤液蒸干时停止加热 | |
| C. | 配制溶液时必须使用的仪器有托盘天平、酒精灯、量筒、烧杯、玻璃棒等 | |
| D. | 配制溶液需要经过计算、称量、溶解、装瓶贴标签等步骤 |
| A. | 容器内气体密度减小 | B. | 平衡向正反应方向移动 | ||
| C. | 二氧化氮的转化率增大 | D. | 四氧化二氮的体积分数减小 |

下列说法正确的是( )
| A. | 荧光素属于高分子化合物 | |
| B. | 荧光素与氧化荧光素都至少有6个碳原子共平面 | |
| C. | 荧光素与氧化荧光素都能与碳酸氢钠反应 | |
| D. | 荧光素与氧化荧光素互为同系物 |
 .
.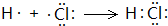 .
.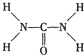 ,尿素分子中σ键和π键数目之比为7:1.
,尿素分子中σ键和π键数目之比为7:1.