题目内容
某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42ˉ、SiO32ˉ、NO3ˉ中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。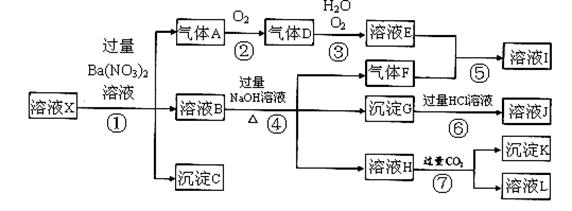
请回答下列问题:
(1)由强酸性条件即可判断溶液X中一定不存在的离子有 :
(2)溶液X中,关于NO3ˉ的判断一定正确的是 ;
a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为 ;
(4)转化⑥发生反应的现象为 ;
(5)转化④中产生H的离子方程式为 ;
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比
为 ;
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是 。
①NaOH溶液, ②KSCN溶液, ③石蕊试剂, ④pH试纸,⑤KMnO4溶液,
⑥氯水和KSCN的混合溶液
(1)CO32ˉ、SiO32ˉ(2分)
(2)b(1分)
(3)3Fe2++NO3ˉ+4H+=2 Fe3++NO+2H2O(2分)
(4)红褐色沉淀溶解,溶液呈黄色(2分)
(5)Al3++4OHˉ=AlO2ˉ+2H2O(1分)
(6)4:1(1分)
(7)②(1分)
解析试题分析:(1)在强酸性溶液中氢离子和碳酸根离子反应生成二氧化碳和水,硅酸根离子和氢离子反应生成硅酸沉淀,所以一定不会存在CO32-和SiO32-离子。
(2)加入过量硝酸钡生成沉淀,钡离子和硫酸根离子反应生成硫酸钡沉淀,说明一定含有SO42-,含有SO42-离子就一定不含Ba2+离子;气体A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+,则在酸性条件下一定不含NO3-离子,答案选b。
(3) 二价铁离子具有还原性,在酸性条件下NO3ˉ具有氧化性,二价铁离子被生成三价铁离子,NO3ˉ被还原成一氧化氮,反应的离子方程式未3Fe2++NO3ˉ+4H+=2Fe3++NO+2H2O。
(4)溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+;溶液B中还有铁离子,加入氢氧化钠溶液生成红褐色沉淀氢氧化铁。由于溶液中一定含有亚铁离子,亚铁离子被氧化可以生成铁离子,所以原溶液中不一定含有铁离子。氢氧化铁被盐酸溶解生成氯化铁和水,所以反应⑥的实验现象是红褐色沉淀溶解,溶液呈黄色。
(5)溶液H中通入CO2气体,生成沉淀K,则K为Al(OH)3,这说明溶液H中含有偏铝酸钠,所以原溶液中含有铝离子,与过量的氢氧化钠溶液反应生成偏铝酸钠,因此转化④中产生H的离子方程式为Al3++4OHˉ=AlO2ˉ+2H2O。
(6)NO2、H2O、O2三种物质恰好发生化合反应,二氧化氮中的氮为+4价,在水中,易被氧气氧化成+5价的氮,反应的化学方程式为4NO2+2H2O+O2=4HNO3,则反应中D与O2的物质的量之比是4:1。
(7)根据以上分析可知,不能确定的离子是铁离子,检验铁离子的试剂是KSCN溶液,答案选②。
考点:考查离子共存以及离子检验的有关判断

已知2MOyx-+5S2-+16H+=2M2++5S↓+8H2O,则MOyx-中的M的化合价为( )
| A.+3 | B.+4 | C.+6 | D.+7 |
 Cr2O72-
Cr2O72- Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O