题目内容
.(16分)二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的广谱消毒剂,是一种黄绿色的气体,易溶于水。
Ⅰ.(1)ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与还原产物的物质的量之比是 。
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:
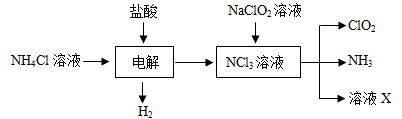
(2)写出电解时发生反应的化学方程式: ;
(3)除去ClO2中的NH3可选用的试剂是 ;(填序号)
(4)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I-+S4O62-),共用去VmL硫代硫酸钠溶液。
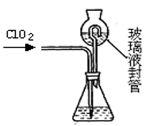
①装置中玻璃液封管的作用是 ;
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式 ;
③滴定终点的现象是: 。
④测得通入ClO2的质量m(ClO2)= 。(用含c、V的代数式表示)
(5)用ClO2处理过的饮用水(PH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO2—。2001年我国卫生部规定,饮用水的ClO2—含量应不超过0.2mg/L。若饮用水中
ClO2—的含量超标,可向其中加入适量的某还原剂,该反应的氧化产物是 (填化学式)。
Ⅰ.(1)ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与还原产物的物质的量之比是 。
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:

(2)写出电解时发生反应的化学方程式: ;
(3)除去ClO2中的NH3可选用的试剂是 ;(填序号)
| A.饱和食盐水 | B.碱石灰 | C.浓硫酸 | D.水 |

①装置中玻璃液封管的作用是 ;
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式 ;
③滴定终点的现象是: 。
④测得通入ClO2的质量m(ClO2)= 。(用含c、V的代数式表示)
(5)用ClO2处理过的饮用水(PH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO2—。2001年我国卫生部规定,饮用水的ClO2—含量应不超过0.2mg/L。若饮用水中
ClO2—的含量超标,可向其中加入适量的某还原剂,该反应的氧化产物是 (填化学式)。
(16分)(1)1:2(2) NH4Cl+2HCl 3H2↑+NCl3(2分)
3H2↑+NCl3(2分)
(3)C(1分)
(4)①吸收残余的二氧化氯气体,并使锥形瓶内外压强相等(2分)
②2ClO2+2I-+8H+=4H2O+I2+2Cl-(2分)
③最后一滴滴下时,溶液由蓝色变为无色,且半分钟内不复原(2分)
④1.35cv×10-2g(2分)
(4)Fe(OH)3(2分)
 3H2↑+NCl3(2分)
3H2↑+NCl3(2分)(3)C(1分)
(4)①吸收残余的二氧化氯气体,并使锥形瓶内外压强相等(2分)
②2ClO2+2I-+8H+=4H2O+I2+2Cl-(2分)
③最后一滴滴下时,溶液由蓝色变为无色,且半分钟内不复原(2分)
④1.35cv×10-2g(2分)
(4)Fe(OH)3(2分)
略

练习册系列答案
 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
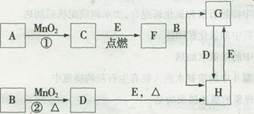
 且E为日常生活中常见金属,其余均 为化合物
且E为日常生活中常见金属,其余均 为化合物 。它们之间的转化关系如图所示(反应中生成的水及次要产物均已略去)。
。它们之间的转化关系如图所示(反应中生成的水及次要产物均已略去)。