题目内容
用15.8g高锰酸钾氧化密度为1.19g/cm3,质量分数为36.5%的盐酸以制取氯气。反应如下:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
求:(1)生成Cl2在标况下的体积;
(2)被KMnO4氧化的盐酸的体积;
(3)反应中转移的电子总数。
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
求:(1)生成Cl2在标况下的体积;
(2)被KMnO4氧化的盐酸的体积;
(3)反应中转移的电子总数。
(1)5.6L(2) 42ml (3)3.01×1023(或0.5NA)
(1)首先计算15.8g高锰酸钾的物质的量为
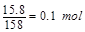
设反应生成的
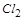 的物质的量为
的物质的量为 ,则由反应的化学方程式
,则由反应的化学方程式2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
知

则有
 ,解得
,解得
标准状况下产生的
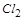 的体积为
的体积为
(2)在反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中,
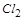 是氧化产物,且
是氧化产物,且
即
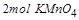 能将
能将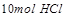 氧化成
氧化成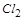
设被氧化的
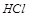 的物质的量为
的物质的量为 ,则有
,则有 ,解得
,解得
设反应中被氧化的
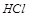 的体积为
的体积为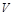 ,则有
,则有
解得
 即被氧化的盐酸的体积大约为
即被氧化的盐酸的体积大约为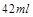
(3)在这个反应中,
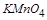 中的
中的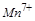 变成了
变成了 中的
中的 ,反应中每个
,反应中每个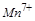 得到了
得到了 个电子,面参加反应的
个电子,面参加反应的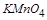 共有
共有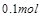 ,所电子转移的总数为
,所电子转移的总数为 ,即
,即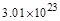 个(或0.5NA)
个(或0.5NA)
练习册系列答案
相关题目
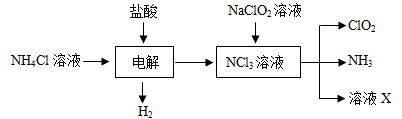
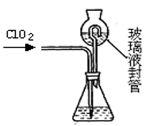
 气进行吸收处理。
气进行吸收处理。 4+H2O中的还原剂为_______________
4+H2O中的还原剂为_______________ 、OH
、OH .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响). L-1H2SO4、1moL
L-1H2SO4、1moL