题目内容
在一定温度下,将等物质的量的CO和水蒸气通入恒容密闭容器中,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),一段时间后反应达到平衡.对该反应描述不正确的是( )
分析:A、该反应向正反应方向移动,导致反应物的物质的量减小,直至平衡;
B、该反应中CO2和H2的初始浓度相等,反应浓度相等,根据剩余浓度=初始浓度-反应浓度判断;
C、该反应向正反应方向移动,初始反应物浓度最大,导致正反应速率大于逆反应速率,直至V正=V逆;
D、该反应是可逆反应,导致18O存在于所有含氧化合物中.
B、该反应中CO2和H2的初始浓度相等,反应浓度相等,根据剩余浓度=初始浓度-反应浓度判断;
C、该反应向正反应方向移动,初始反应物浓度最大,导致正反应速率大于逆反应速率,直至V正=V逆;
D、该反应是可逆反应,导致18O存在于所有含氧化合物中.
解答:解:A、该反应向正反应方向移动,所以反应物的物质的量减小,直至达平衡状态,故A正确;
B、反应由CO(g)和H2O(g)开始到达平衡,CO2和H2物质的量按照1:1生成,所以,此间CO2和H2的浓度总是相等,故B正确;
C:反应由正反应开始,未达平衡前,反应向正反应进行,V正>V逆,到达平衡时V正=V逆,故C正确;
D:CO、H2O、CO2中都可能含有18O,故D错误.
故选D.
B、反应由CO(g)和H2O(g)开始到达平衡,CO2和H2物质的量按照1:1生成,所以,此间CO2和H2的浓度总是相等,故B正确;
C:反应由正反应开始,未达平衡前,反应向正反应进行,V正>V逆,到达平衡时V正=V逆,故C正确;
D:CO、H2O、CO2中都可能含有18O,故D错误.
故选D.
点评:本题考查了化学平衡移动原理,难度不大,会分析浓度对化学反应速率的影响图象是解本题的关键.

练习册系列答案
相关题目

 n C(g)+q D(s)。
n C(g)+q D(s)。
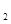 O外,还有H
O外,还有H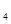 外,还有C
外,还有C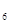 等;与之相似的氮元素的氢化物除外,还有N
等;与之相似的氮元素的氢化物除外,还有N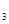 对农业、化学、国防工业具有重要意义。其合成原理为:
对农业、化学、国防工业具有重要意义。其合成原理为: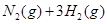


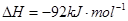
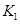 =
(只列数字表达式)
=
(只列数字表达式) ,同
,同