题目内容
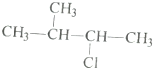
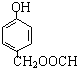
11.下列各组物质中,不属于同分异构体的是( )| A. | 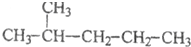 和 和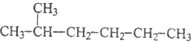 | |
| B. | CH3-CH2NO2和H2N-CH2-COOH | |
| C. | CH2═CH-CH2-COOH和CH3-CH═CH-COOH | |
| D. | CH3-CH2-O-CH2-CH3和 |
分析 分子式相同、结构不同的化合物互为同分异构体,所以互为同分异构体的化合物必须满足三要素:分子式相同、结构不同、化合物,据此进行解答.
解答 解:A、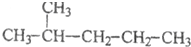 和
和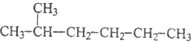 分子式不相同,结构相似,分子组成上相差1个CH2原子团,属于同系物,不属于同分异构体,故A选;
分子式不相同,结构相似,分子组成上相差1个CH2原子团,属于同系物,不属于同分异构体,故A选;
B、CH3-CH2NO2和H2N-CH2-COOH分子式相同,结构不同,属于同分异构体,故B不选;
C、CH2═CH-CH2-COOH和CH3-CH═CH-COOH,分子式相同,碳碳双键的位置不同,属于同分异构体,故C不选;
D、CH3-CH2-O-CH2-CH3和 分子式相同,结构不同,属于同分异构体,故D不选,
分子式相同,结构不同,属于同分异构体,故D不选,
故选A.
点评 本题考查了同分异构体的判断、有机物的结构,题目难度不大,注意对同分异构体定义的理解,也要注意区别同系物.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.每克下列物质氧化放出能量最高的是( )
| A. | 蛋白质 | B. | 糖类 | C. | 油脂 | D. | 维生素 |
6.将1 mol冰醋酸加人到一定量的蒸馏水中最终得到1L溶液.下列各项中,表明已达到电离平衡状态的是( )
| A. | 醋酸的浓度达到1 mol•L-1 | |
| B. | H+的浓度达到0.5 mol•L-1 | |
| C. | 醋酸分子的浓度、醋酸根离子的浓度、H+的浓度均为0.5 mol•L-1 | |
| D. | 醋酸分子电离成离子的速率和离子重新结合成醋酸分子的速率相等. |
3.湿化学法(NPP-法)制备纳米级活性氧化锌,可以用氧化锌粗品(含有FeO、Fe2O3、CuO杂质)为原料,采用酸浸出锌,经过多次净化除去原料中的杂质,然后沉淀获得碱式碳酸锌,最后焙烧获得活性氧化锌.其化学工艺流程如图:
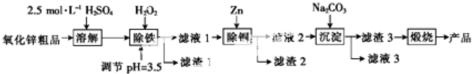
已知:溶液中Fe2+、Fe3+、Cu2+、Zn2+以氢氧化物的形式沉淀时的pH如表:
(1)实验室用98%浓H2SO4(ρ=1.84g/cm3)来配制100ml 2.5mol/L稀H2SO4所需的玻璃仪器有烧杯、胶头滴管、00mL容量瓶、量筒、玻璃棒.
(2)上述流程图中pH=12的Na2CO3溶液中阴离子的浓度由大到小的顺序为c(CO32-)>c(OH-)>c(HCO3-).
(3)滤渣1是Fe(OH)3(填化学式,下同),滤渣2是Cu、Zn.加入H2O2时发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)“沉淀”得到ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,“煅烧”反应的化学方程式为ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.

已知:溶液中Fe2+、Fe3+、Cu2+、Zn2+以氢氧化物的形式沉淀时的pH如表:
| 离子 | 开始沉 淀的pH | 完全沉 淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.7 | 3.2 |
| Cu2+ | 5.2 | 6.7 |
| Zn2+ | 6.8 | 9.0 |
(2)上述流程图中pH=12的Na2CO3溶液中阴离子的浓度由大到小的顺序为c(CO32-)>c(OH-)>c(HCO3-).
(3)滤渣1是Fe(OH)3(填化学式,下同),滤渣2是Cu、Zn.加入H2O2时发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)“沉淀”得到ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,“煅烧”反应的化学方程式为ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
 .
.
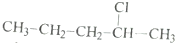

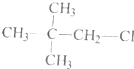
 发生酯化反应的产物.
发生酯化反应的产物.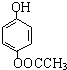 、
、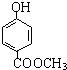 、
、 (其中之一).
(其中之一).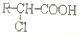

 .
.