题目内容
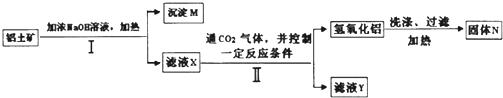
1.某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化: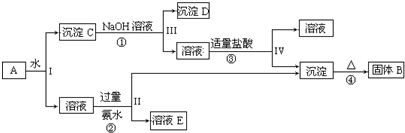
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是过滤.
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式:固体BAl2O3;沉淀CAl2O3、Fe2O3;沉淀DFe2O3;溶液EK2SO4、(NH4)2SO4和NH3•H2O.
(3)写出①、②、③、④四个反应方程式(②、③写离子方程式①、④写化学方程式)
①Al2O3+2NaOH+3H2O═2Na[Al(OH)4];②Al3++3NH3•H2O═Al(OH)3↓+3NH4+;③[Al(OH)4]-+H+═Al(OH)3↓+H2O;④2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.
分析 混合物A含有KAl(SO4)2、Al2O3和Fe2O3,加水后经过滤分离可得溶液KAl(SO4)2和Al2O3、Fe2O3沉淀混合物C,加入NaOH溶液,NaOH和Al2O3反应生成NaAlO2,过滤后得到NaAlO2溶液,沉淀D为Fe2O3,加入盐酸得到FeCl3,NaAlO2溶液中加入适量盐酸,反应生成Al(OH)3和NaCl,Al(OH)3加热分解生成B为Al2O3,溶液E为K2SO4和(NH4)2SO4和NH3•H2O混合物,结合对应的物质的性质以及题目要求解答该题.
解答 解:混合物A含有KAl(SO4)2、Al2O3和Fe2O3,加水后经过滤分离可得溶液KAl(SO4)2和Al2O3、Fe2O3沉淀混合物C,加入NaOH溶液,NaOH和Al2O3反应生成NaAlO2,过滤后得到NaAlO2溶液,沉淀D为Fe2O3,加入盐酸得到FeCl3,NaAlO2溶液中加入适量盐酸,反应生成Al(OH)3和NaCl,Al(OH)3加热分解生成B为Al2O3,溶液E为K2SO4和(NH4)2SO4和NH3•H2O混合物,
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是过滤,
故答案为:过滤;
(2)根据上面的分析可知,固体B为Al2O3,沉淀C为Al2O3、Fe2O3混合物,沉淀D为Fe2O3,溶液E为K2SO4、(NH4)2SO4和NH3•H2O,
故答案为:Al2O3;Al2O3、Fe2O3;Fe2O3;K2SO4、(NH4)2SO4和NH3•H2O;
(3)反应①的化学方程式为Al2O3+2NaOH+3H2O═2Na[Al(OH)4]、反应②的离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+、反应③的离子方程式为Al(OH)4]-+H+═Al(OH)3↓+H2O、反应④的化学方程式为2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
故答案为:Al2O3+2NaOH+3H2O═2Na[Al(OH)4];Al3++3NH3•H2O═Al(OH)3↓+3NH4+;[Al(OH)4]-+H+═Al(OH)3↓+H2O;2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.
点评 本题考查物质的分离方法及选择,为高频考点,把握物质的性质及混合物分离提纯方法等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

| A. | 3:4 | B. | 1:4 | C. | 1:2 | D. | 3:2 |
| A. | Cu(OH)2和HCl;Cu(OH)2和CH3COOH | |
| B. | Ba(OH)2和MgSO4;BaCl2和(NH4)2SO4 | |
| C. | Na2CO3和H2SO4;K2CO3和NaHSO4 | |
| D. | NaHCO3和Ca(OH)2(过量); NaHCO3(过量)和Ca(OH)2 |
| A. | 标准状况下11.2L CO2和0.5 molCO2 | |
| B. | 18 mL H2O和2x10Pa,27C 16gO2 | |
| C. | 1 molCO和88gCO2 | |
| D. | 27℃,22.4 LCl2和含4mol氧原子的H2SO4 |
| A. | 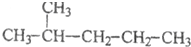 和 和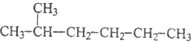 | |
| B. | CH3-CH2NO2和H2N-CH2-COOH | |
| C. | CH2═CH-CH2-COOH和CH3-CH═CH-COOH | |
| D. | CH3-CH2-O-CH2-CH3和 |

 向仅含Fe2+、I-、Br-的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示. (已知氧化性:Br2>Fe3+>I2)请回答下列问题:
向仅含Fe2+、I-、Br-的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示. (已知氧化性:Br2>Fe3+>I2)请回答下列问题: