题目内容
已知在25℃,101kPa下,lgC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是
| A.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(g) ?H=-48.40kJ/mol |
| B.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) ?H=-5518kJ/mol |
| C.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) ?H=+5518kJ/mol |
| D.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) ?H=-48.40kJ/mol |
B
试题分析:首先写出化学方程式并注明各物质的状态,特别是H2O为液态,然后由lgC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量,求出1molC8H18燃烧生成二氧化碳和液态水放出的热量:48.4kJ×114=5518kJ,即?H=-5518kJ?mol?1,故B项正确。

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目


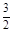 O2(g)=CO2(g)+2H2O(l)△H=+725.8 kJ·mol-1
O2(g)=CO2(g)+2H2O(l)△H=+725.8 kJ·mol-1