题目内容
下列溶液均处于25℃,有关叙述正确的是
| A.将醋酸溶液加水稀释1000倍,pH增大3 |
| B.在NaHCO3溶液中,c(Na+)=c(HCO3-)+c(H2CO3) |
| C.pH=8的Ba(OH)2溶液和pH=8的氨水中,由水电离的c(OH-)均为1×10-8mo1·L-1 |
| D.pH=13的NaOH溶液与pH=1的盐酸混合后,一定有c(H+)=c(OH-) |
C
试题分析:A、醋酸是弱酸,稀释促进醋酸电离出H+,则稀释1000倍时pH增大不到3个单位,错误;B、碳元素还有部分以CO32—存在,由物料守恒原理可得:c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32—),错误;C、pH=8的溶液中c(H+)=10—8mol?L—1,强碱或弱碱均抑制水的电离,则水电离的c(H+)=10—8mol?L—1,所以水电离的c(OH-)=10—8mol?L—1,正确;D、等体积混合时溶液呈中性,强酸过量显酸性,强碱过量显碱性,错误。

练习册系列答案
相关题目
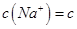 (Cl-)
(Cl-)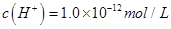 ,则此溶液中K+、
,则此溶液中K+、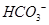 、Cl—、
、Cl—、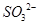 可以大量共存
可以大量共存