题目内容
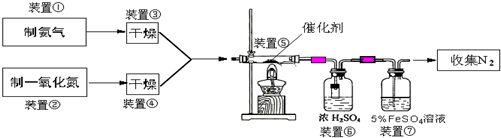
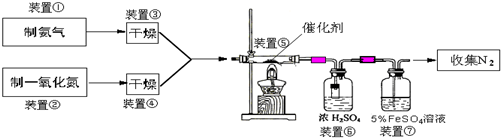
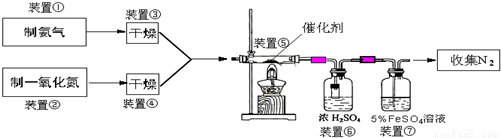
NH3在催化剂存在时能还原NOx为N2和H2O,这是目前国外硝酸厂进行尾气治理所普遍采用的一种方法.下图是某校化学兴趣小组设计的模拟氨气还原NO的装置. 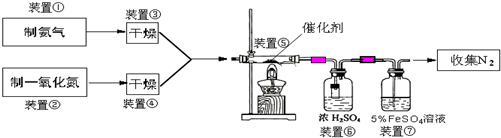
回答下列问题:
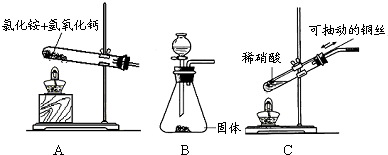
(1)若制取氨气用A装置,则发生反应的化学方程式为

(2)若制取NO用图C装置,则制取NO的离子方程式为
(3)装置⑦的作用可能是
(4)活性亚铬酸铜(可写成xCuO?yCr2O3的形式,x、y为正整数)是氨气还原NO催化剂.已知CuNH4(OH)CrO4在295℃分解生成活性亚铬酸铜催化剂、一种无毒气体及水,写出该反应的化学方程式
(5)若进入装置⑤的NO共2688mL(已折算为标准状况,下同),氨气过量,最后收集到标准状况下2016mL N2,则NO的转化率为

回答下列问题:
(1)若制取氨气用A装置,则发生反应的化学方程式为
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
.若用B装置制取氨气,则分液漏斗和锥形瓶中盛放的药品分别是
| ||
浓氨水、碱石灰
浓氨水、碱石灰
.
(2)若制取NO用图C装置,则制取NO的离子方程式为
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
,用可抽动的铜丝其优点是反应可以随时关停、操作方便、反复使用、节约药品
反应可以随时关停、操作方便、反复使用、节约药品
.(3)装置⑦的作用可能是
吸收未反应的NO
吸收未反应的NO
.(4)活性亚铬酸铜(可写成xCuO?yCr2O3的形式,x、y为正整数)是氨气还原NO催化剂.已知CuNH4(OH)CrO4在295℃分解生成活性亚铬酸铜催化剂、一种无毒气体及水,写出该反应的化学方程式
2Cu(OH)NH4CrO4
Cr2O3?2CuO+N2↑+5H2O
| ||
2Cu(OH)NH4CrO4
Cr2O3?2CuO+N2↑+5H2O
.
| ||
(5)若进入装置⑤的NO共2688mL(已折算为标准状况,下同),氨气过量,最后收集到标准状况下2016mL N2,则NO的转化率为
90%
90%
.分析:(1)在加热条件下,实验室常用氯化铵和氢氧化钙反应制备氨气,同时生产氯化钙和水,实验室制备少量氨气时可根据氨水的易挥发性和氧化钙的吸水性来制取;
(2)根据铜和稀硝酸反应生产硝酸铜和一氧化氮结合反应遵循电荷守恒、电子守恒以及质量守恒来书写离子方程式,用可抽动的铜丝易于控制反应,操作方便.
(3)硫酸亚铁吸收NO,生成配合物;
(4)CuNH4(OH)CrO4在295℃分解生成活性亚铬酸铜催化剂、一种无毒气体及水,产物中无毒气体为氮气,根据质量守恒书写化学方程式;
(5)根据反应6NO+4NH3═5N2+6H2O计算转化率.
(2)根据铜和稀硝酸反应生产硝酸铜和一氧化氮结合反应遵循电荷守恒、电子守恒以及质量守恒来书写离子方程式,用可抽动的铜丝易于控制反应,操作方便.
(3)硫酸亚铁吸收NO,生成配合物;
(4)CuNH4(OH)CrO4在295℃分解生成活性亚铬酸铜催化剂、一种无毒气体及水,产物中无毒气体为氮气,根据质量守恒书写化学方程式;
(5)根据反应6NO+4NH3═5N2+6H2O计算转化率.
解答:解:(1)在加热条件下,实验室常用氯化铵和氢氧化钙反应制备氨气,同时生产氯化钙和水,方程式为2
NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,实验室制备少量氨气时可根据氨水的易挥发性和氧化钙的吸水性来制取,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;浓氨水、碱石灰;
(2)铜和稀硝酸反应生产硝酸铜和一氧化氮,离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,用可抽动的铜丝易于控制反应,操作方便并能节约药品,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;反应可以随时关停、操作方便、反复使用、节约药品;
(3)一氧化氮与二价铁形成配位键,溶液中淡绿色的二价铁变成棕色的一氧化氮配合物,反应为Fe2++NO=Fe(NO)2+,故答案为:吸收未反应的NO;
(4)CuNH4(OH)CrO4在295℃分解生成活性亚铬酸铜催化剂、一种无毒气体及水,产物中无毒气体为氮气,反应方程式为2Cu(OH)NH4CrO4
Cr2O3?2CuO+N2↑+5H2O,
故答案为:2Cu(OH)NH4CrO4
Cr2O3?2CuO+N2↑+5H2O;
(5)根据反应6NO+4NH3═5N2+6H2O计算,在一定条件下气体的体积之比等于物质的量之比,
6NO+4NH3═5N2+6H2O
6ml 5ml
V 2016ml
V=
=2419.2ml,则NO的转化率为
×100%=90%,
故答案为:90%.
NH4Cl+Ca(OH)2
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(2)铜和稀硝酸反应生产硝酸铜和一氧化氮,离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,用可抽动的铜丝易于控制反应,操作方便并能节约药品,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;反应可以随时关停、操作方便、反复使用、节约药品;
(3)一氧化氮与二价铁形成配位键,溶液中淡绿色的二价铁变成棕色的一氧化氮配合物,反应为Fe2++NO=Fe(NO)2+,故答案为:吸收未反应的NO;
(4)CuNH4(OH)CrO4在295℃分解生成活性亚铬酸铜催化剂、一种无毒气体及水,产物中无毒气体为氮气,反应方程式为2Cu(OH)NH4CrO4
| ||
故答案为:2Cu(OH)NH4CrO4
| ||
(5)根据反应6NO+4NH3═5N2+6H2O计算,在一定条件下气体的体积之比等于物质的量之比,
6NO+4NH3═5N2+6H2O
6ml 5ml
V 2016ml
V=
| 2016ml×6ml |
| 5ml |
| 2419.2 |
| 2688 |
故答案为:90%.
点评:本题考查氨气的制取和性质等知识,题目较为综合,具有一定难度,本题中注意少量氨气制取的方法以及NO尾气的吸收等问题,这在课本中是不多见的.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目