题目内容
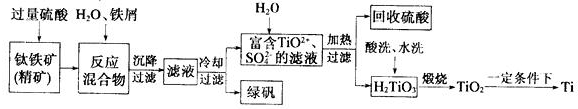
13.四氯化钛(TiCl4)是制取航天航空工业材料--钛合金的重要原料.由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意图如下: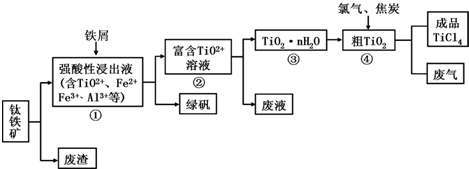
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性.该过程中有如下反应发生:
2Fe3++Fe═3Fe2+ 2TiO2+(无色)+Fe+4H+═2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O═TiO2+(无色)+Fe2++2H+
加入铁屑的作用是生成Ti3+,保护Fe2+不被氧化.
(2)在②→③工艺过程中需要控制条件以形成TiO2•nH2O溶胶,该溶胶的分散质颗粒直径大小在10-9~10-7m(或1nm-100nm)范围.
(3)写出④中TiO2和焦炭、氯气反应的化学方程式:TiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+2CO.
(4)上述工艺具有成本低、可用低品位矿物为原料等优点.依据绿色化学理念,该工艺流程中存在的不足之处是产生了废气,废液,废渣等(只要求写出一项 ).
(5)依据表格信息,要精制含少量SiCl4杂质的TiCl4,可采用蒸馏(或分馏)方法.
| TiCl4 | SiCl4 | |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
分析 钛铁矿中加入强酸,强酸性浸出液中含有TiO2+、Fe2+、Fe3+、Al3+等,①中加入铁屑至浸出液显紫色,此时溶液呈强酸性,该过程中有如下反应发生:2Fe3++Fe=3Fe2+;2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O,通过一系列过程得到绿矾FeSO4.7H2O和含有TiO2+溶液,将溶液处理得到TiO2•nH2O,将粗TiO2和氯气、焦炭混合加热得到TiCl4,发生反应TiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+2CO,得到的废气是SO2,
(1)往①中加入铁屑至浸出液显紫色,说明浸出液中含有Ti3+,由方程式可知,Fe3+氧化为Ti3+;
(2)控制条件以形成TiO2•n H2O溶胶,说明得到胶体,其分散质颗粒直径大小为10-9~10-7m(或1nm-100nm);
(3)根据上面的分析可知,④中TiO2和焦炭、氯气反应生成TiCl4和CO;
(4)绿色化学应零污染、零排放,原子利用率100%.结合工艺流程三废回答;
(5)由表中数据可知,SiCl4、TiCl4为液体,二者沸点相差较大,通常采取蒸馏方法分离.
解答 解:钛铁矿中加入强酸,强酸性浸出液中含有TiO2+、Fe2+、Fe3+、Al3+等,①中加入铁屑至浸出液显紫色,此时溶液呈强酸性,该过程中有如下反应发生:2Fe3++Fe=3Fe2+;2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O,通过一系列过程得到绿矾FeSO4.7H2O和含有TiO2+溶液,将溶液处理得到TiO2•nH2O,将粗TiO2和氯气、焦炭混合加热得到TiCl4,发生反应TiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+2CO,得到的废气是SO2,
(1)往①中加入铁屑至浸出液显紫色,说明浸出液中含有Ti3+,由方程式可知,Fe3+氧化为Ti3+,加入铁屑作还原剂,将Fe3+还原为Fe2+,防止Ti3+被Fe3+氧化成TiO2+,
故答案为:生成Ti3+,保护Fe2+不被氧化;
(2)控制条件以形成TiO2•n H2O溶胶,说明得到胶体,其分散质颗粒直径大小为10-9~10-7m(或1nm-100nm),
故答案为:10-9~10-7m(或1nm-100nm);
(3)根据上面的分析可知,④中反应方程式为TiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+2CO,
故答案为:TiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+2CO;
(4)由工艺流程可知,生成中产生废气,废液,废渣等,不符合绿色化学理念,
故答案为:产生了废气,废液,废渣等;
(5)由表中数据可知,SiCl4、TiCl4为液体,二者沸点相差较大,要精制含少量SiCl4杂质的TiCl4,可采用蒸馏(或分馏)方法,
故答案为:蒸馏(或分馏).
点评 本题考查学生阅读题目获取信息能力、氧化还原反应、绿色化学、胶体、物质分离提纯等,难度不大,注意基础知识的掌握利用.

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案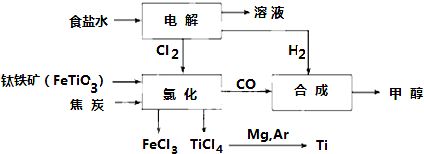
请回答下列问题:
(1)Fe位于元素周期表中第四周期第VIII族.
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2•xH2O,再经焙烧制得.写出TiCl4水解的化学方程式:TiCl4+(2+x)H2O=TiO2.xH2O↓+4HCl.
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
| 元素 | 相关信息 |
| X | 所有元素中原子半径最小的元素 |
| Y | 地壳中含量最多的元素 |
| Z | 短周期中原子半径最大的金属元素 |
| M | 与Y同主族 |
(2)X、Z可形成化合物ZX,ZX的电子式为Na+[:H]-(用元素符号表示),ZX与盐酸反应.每生成1molX2时转移电子的物质的量为1mol
(3)实验室中检验N的简单离子的试剂是稀硝酸和硝酸银溶液,反应的离子方程式为Ag++Cl-=AgCl↓
(4)M的氢化物5.6L(标准状况下)完全燃烧生成气态氧化物后恢复到室温,放出的热量为127.6kJ,该条件下反应的热化学方程式为2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-510.4kJ/mol.
(1)写出反应中涉及的化学方程式(至少3个)
(2)通过计算,填写下表:
| c(H+) | c(SO42-) | c(Fe2+、Fe3+) |
(3)计算原溶液中Fe2+被氧化的百分率.
A.氟利昂 B.SO2C.NO2D.CO2
| 环境问题 | 造成环境问题的主要物质 |
| 温室效应 | |
| 酸雨 | |
| 南极臭氧层空洞 | |
| 光化学烟雾 |