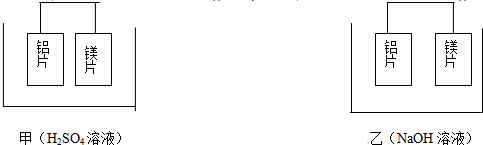题目内容
3.海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图:
回答下列问题:
(1)流程图中操作①的名称为蒸发结晶.
(2)有同学认为:可直接加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则.你不同意(填“同意”或“不同意”该同学的想法,理由是因为MgO熔点很高,熔融时耗费大量的能量而增加生产成本;
(3)该流程图里B、C反应可以生产工业上一重要产品,写出该反应的化学方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
分析 海水通过蒸发结晶晒盐得到粗盐和母液,粗盐精制得到精盐溶解制备饱和溶液,通电电解得到氢氧化钠溶液、氯气、氢气,N为HCl,M为NaClO,贝壳煅烧得到氧化钙,溶于水得到氢氧化钙,加入母液沉淀镁离子生成氢氧化镁沉淀,加入盐酸溶解得到氯化镁溶液浓缩蒸发,冷却结晶得到氯化镁晶体,氯化氢气流中加热得到氯化镁,电解熔融氯化镁得到镁和氯气,氯气通过母液氧化溴离子为溴单质,通过热的空气吹出溴单质,C为Cl2,D为Mg,据此回答;
(1)操作①是从海水中得到粗盐和卤水,通过蒸发溶剂的方法得到;
(2)氧化镁熔点很高熔融电解需要消耗大量能量分析;
(3)BC反应是氯气和氢氧化钙发生反应生成漂白粉的过程,生成氯化钙、次氯酸钙和水;
解答 解:海水通过蒸发结晶晒盐得到粗盐和母液,粗盐精制得到精盐溶解制备饱和溶液,通电电解得到氢氧化钠溶液、氯气、氢气,N为HCl,M为NaClO,贝壳煅烧得到氧化钙,溶于水得到氢氧化钙,加入母液沉淀镁离子生成氢氧化镁沉淀,加入盐酸溶解得到氯化镁溶液浓缩蒸发,冷却结晶得到氯化镁晶体,氯化氢气流中加热得到氯化镁,电解熔融氯化镁得到镁和氯气,氯气通过母液氧化溴离子为溴单质,通过热的空气吹出溴单质,C为Cl2,D为Mg,据此回答;
(1)操作①是从海水中得到粗盐和卤水,通过蒸发溶剂的方法得到晶体,流程图中操作①的名称为蒸发结晶,
故答案为:蒸发结晶;
(2)氧化镁熔点很高熔融电解需要消耗大量能量,电解熔融的MgO制金属镁熔融时耗费大量的能量而增加生产成本,
故答案为:不同意,因为MgO熔点很高,熔融时耗费大量的能量而增加生产成本;
(3)BC反应是氯气和氢氧化钙发生反应生成漂白粉的过程,生成氯化钙、次氯酸钙和水 的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
点评 本题考查了电解池的工作原理知识,粗盐提纯的实验方案设计步骤及注意事项以及化学方程式的书写,化学来源于生产、生活,又服务于生产、生活,学习中注意积累化学知识,才能综合应用,题目难度中等.

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案| A. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 | |
| B. | 食用油和人造奶油都是油酸甘油酯 | |
| C. | 只要符合限量,“食用色素”、“亚硝酸盐”可以作为某些食品的添加剂 | |
| D. | 鸡蛋清中加入胆矾可以使蛋白质发生盐析 |
| A. | CH3-CH2OH | B. | CH3-COOH | C. | CH2Cl-CH2Cl | D. | CH3CH2Cl |
| 选项 | 实验目的 | 实验方案 |
| A | 比较苯酚和乙醇中羟基氢的活泼性强弱 | 用氢氧化钠分别与苯酚和乙醇反应 |
| B | 证明HOCH2CH2CHO中含有醛基 | 滴入KMnO4酸性溶液 |
| C | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变成红色 |
| D | 检验乙醇与浓硫酸共热是否产生乙烯 | 将乙醇与浓硫酸共热至170℃,所得气体通入酸性高锰酸钾溶液中,观察溶液是否褪色 |
| A. | A | B. | B | C. | C | D. | D |
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HC1 | B. | 2CH3CH2OH+02$\stackrel{Cu、△}{→}$2CH3CH0+2H20 | ||
| C. | 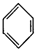 +HNO3$→_{50-60℃}^{浓硫酸}$ +HNO3$→_{50-60℃}^{浓硫酸}$ +H2O +H2O | D. | nCH2=CH2$\stackrel{一定条件}{→}$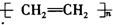 |
| A. | 原子最外层电子数:X>Y>Z | B. | 原子序数:X>Y>Z | ||
| C. | 单质沸点:Z>Y>X | D. | 离子半径:X2->Y+>Z- |
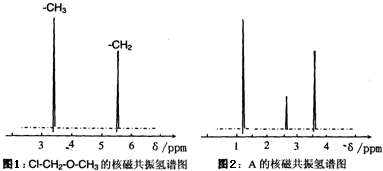
 .
.