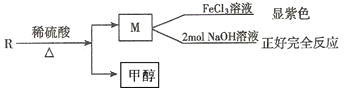
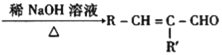题目内容
【题目】合成氨工业对国民经济和社会发展具有重要意义,对于密闭容器中的反应:![]()
(1)写出该反应的逆反应的化学平衡常数表达式______,升高温度,该反应化学反应速率______,氢气的转化率______![]() 以上均填“增大”、“减小”或“不变”
以上均填“增大”、“减小”或“不变”![]() 。实际生产中温度一般控制在
。实际生产中温度一般控制在![]() ,原因是______。
,原因是______。
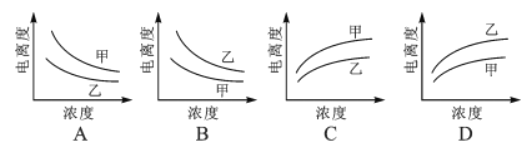
(2)能表示该反应在恒温恒容密闭容器中![]() 时刻后已经达到平衡状态的图示是______。
时刻后已经达到平衡状态的图示是______。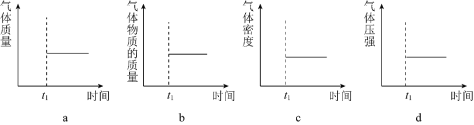
(3)浓度![]() 的氨水,pH为
的氨水,pH为![]() 当用蒸馏水稀释100倍时,则
当用蒸馏水稀释100倍时,则![]() 的电离平衡将向______方向移动
的电离平衡将向______方向移动![]() 填“正”或“逆”
填“正”或“逆”![]() ,溶液的pH将为______
,溶液的pH将为______![]() “大于”“小于”“等于”
“大于”“小于”“等于”![]() 。
。
设计一个简单实验,证明一水合氨是弱碱:______。
某化学兴趣小组进行了下列关于氯化铵的课外实验:
(实验操作)
![]()
浸过氯化钠溶液的布条很快烧光,浸过氯化铵溶液的布条不燃烧,冒出白烟。
(4)氯化铵饱和溶液中离子浓度由大到小的顺序是______。白烟的成分是______。
(5)请推测浸过氯化铵溶液的布条不燃烧、不易着火的主要原因![]() 写出一条即可
写出一条即可![]() ______
______
【答案】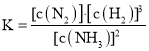 增大 减小 此温度下催化剂的活性较高 bd 正 大于 测得室温下
增大 减小 此温度下催化剂的活性较高 bd 正 大于 测得室温下![]() 氨水的pH小于10,则证明一水合氨是弱碱
氨水的pH小于10,则证明一水合氨是弱碱 ![]()
![]() 氯化铵分解吸收热量,降低了温度或氯化铵分解产生的气体隔绝了空气等
氯化铵分解吸收热量,降低了温度或氯化铵分解产生的气体隔绝了空气等
【解析】
![]() 为生成物浓度幂之积与反应物浓度幂之积的比;升高温度平衡逆向移动,反应速率加快,一般控制在
为生成物浓度幂之积与反应物浓度幂之积的比;升高温度平衡逆向移动,反应速率加快,一般控制在![]() ,与催化剂活性高有关;
,与催化剂活性高有关;
![]() 平衡时正逆反应速率相等、各物质的含量不变;
平衡时正逆反应速率相等、各物质的含量不变;
![]() 稀释促进电离,电离平衡正向移动;
稀释促进电离,电离平衡正向移动;
![]() 氯化铵饱和溶液中铵根离子水解显酸性,且白烟为氯化铵;
氯化铵饱和溶液中铵根离子水解显酸性,且白烟为氯化铵;
![]() 过氯化铵溶液的布条不燃烧、不易着火,与氯化铵分解吸热有关。
过氯化铵溶液的布条不燃烧、不易着火,与氯化铵分解吸热有关。
解:![]() 该反应的逆反应的化学平衡常数表达式为
该反应的逆反应的化学平衡常数表达式为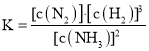 ;升高温度,该反应化学反应速率增大,平衡逆向移动,氢气的转化率减小。实际生产中温度一般控制在
;升高温度,该反应化学反应速率增大,平衡逆向移动,氢气的转化率减小。实际生产中温度一般控制在![]() ,原因是此温度下催化剂的活性较高;
,原因是此温度下催化剂的活性较高;
故答案为: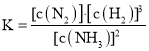 ;增大;减小;此温度下催化剂的活性较高;
;增大;减小;此温度下催化剂的活性较高;
![]() 均为气体,恒容时混合气体的质量、密度始终不变,气体的物质的量、压强不变时达到平衡状态;
均为气体,恒容时混合气体的质量、密度始终不变,气体的物质的量、压强不变时达到平衡状态;
故答案为:bd;
![]() 浓度
浓度![]() 的氨水,pH为
的氨水,pH为![]() 当用蒸馏水稀释100倍时,则
当用蒸馏水稀释100倍时,则![]() 的电离平衡将向正方向移动,溶液的pH将为大于9,证明一水合氨是弱碱,实验方法为测得室温下
的电离平衡将向正方向移动,溶液的pH将为大于9,证明一水合氨是弱碱,实验方法为测得室温下![]() 氨水的pH小于10,则证明一水合氨是弱碱等;
氨水的pH小于10,则证明一水合氨是弱碱等;
故答案为:正;大于;测得室温下![]() 氨水的pH小于10,则证明一水合氨是弱碱等;
氨水的pH小于10,则证明一水合氨是弱碱等;
![]() 氯化铵饱和溶液中,铵根离子水解显酸性,则离子浓度由大到小的顺序是
氯化铵饱和溶液中,铵根离子水解显酸性,则离子浓度由大到小的顺序是![]() ,白烟的成分是
,白烟的成分是![]() ;
;
故答案为:![]() ;
;![]() ;
;
![]() 浸过氯化铵溶液的布条不燃烧、不易着火的主要原因氯化铵分解吸收热量,降低了温度或氯化铵分解产生的气体隔绝了空气等;
浸过氯化铵溶液的布条不燃烧、不易着火的主要原因氯化铵分解吸收热量,降低了温度或氯化铵分解产生的气体隔绝了空气等;
故答案为:氯化铵分解吸收热量,降低了温度或氯化铵分解产生的气体隔绝了空气等。

【题目】表是25℃时某些弱酸的电离平衡常数,下列说法正确的是( )
化学式 | CH3COOH | HClO | H2CO3 |
Ka | 1.8×10﹣5 | 3.0×10﹣8 | Ka1=4.1×10﹣7 Ka2=5.6×10﹣11 |
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B. 向0.1mol·L﹣1CH3COOH溶液中滴加NaOH溶液至溶液pH=5,此时溶液中c(CH3COOH):c(CH3COO﹣)=9:5
C. 少量碳酸氢钠固体加入到新制的氯水中,c(HClO)增大
D. 等体积等物质的量浓度的CH3COONa(aq)与NaClO(aq)中离子总数大小:N前<N后