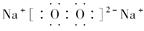题目内容
下表为元素周期表中的一部分,列出了10种元素在元素周期表中的位置。试用元素符号、离子符号或化学式回答下列问题。
(1)10种元素中,化学性质最不活泼的是 ;(填元素符号)
(2)①③⑤三种元素最高价氧化物对应水化物中,碱性最强的是 ,(填化学式)该物质内部含有的化学键类型是 和 ;
(3)元素⑦的氢化物的化学式为 ;该氢化物常温下和元素②的单质反应的化学方程式 ;
(4)③和⑨两元素形成化合物的电子式是 ;①和⑦两元素形成四核化合物的电子式是 ,该物质与CO2反应的化学方程式为 ;
(5)①和⑤最高价氧化物对应水化物相互反应的离子方程式为:
。
| | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 第2周期 | | | | ⑥ | | ⑦ | | |
| 第3周期 | ① | ③ | ⑤ | | ⑧ | | ⑨ | ⑩ |
| 第4周期 | ② | ④ | | | | | | |
(2)①③⑤三种元素最高价氧化物对应水化物中,碱性最强的是 ,(填化学式)该物质内部含有的化学键类型是 和 ;
(3)元素⑦的氢化物的化学式为 ;该氢化物常温下和元素②的单质反应的化学方程式 ;
(4)③和⑨两元素形成化合物的电子式是 ;①和⑦两元素形成四核化合物的电子式是 ,该物质与CO2反应的化学方程式为 ;
(5)①和⑤最高价氧化物对应水化物相互反应的离子方程式为:
。
(1) Ar
(2) NaOH ; 离子键; 极性共价键(或答共价键或极性键均对)
(3) H2O ;2K + 2H2O ="2KOH" +H2↑;
(4) ;
;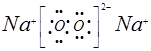
2Na2O2 + 2CO2 = 2Na2CO3 +O2 ;
(5) Al(OH)3 + OH— =AlO2— + 2H2O
(2) NaOH ; 离子键; 极性共价键(或答共价键或极性键均对)
(3) H2O ;2K + 2H2O ="2KOH" +H2↑;
(4)
 ;
;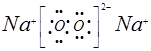
2Na2O2 + 2CO2 = 2Na2CO3 +O2 ;
(5) Al(OH)3 + OH— =AlO2— + 2H2O
试题分析:⑩处在第三周期0族元素是Ar,化学性质最不活泼。
(2)①③⑤三种元素分别为Na、Mg、Al、其对应的最高价氧化物对应水化物中碱性最强的是NaOH
含有的化学键类型是离子键; 极性共价键
(3)元素⑦的氢化物的化学式为H2O;元素②是K,两者发生反应的化学方程式:2K + 2H2O ="2KOH" +H2↑
(4)③为Mg、⑨为Cl,两元素形成化合物的电子式是
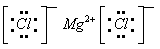
 ①是Na,⑦是O,两元素形成四核化合物的电子式是
①是Na,⑦是O,两元素形成四核化合物的电子式是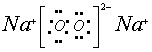
 Na2O2与CO2反应的化学方程式为2Na2O2 + 2CO2 = 2Na2CO3 +O2
Na2O2与CO2反应的化学方程式为2Na2O2 + 2CO2 = 2Na2CO3 +O2(5)①和⑤最高价氧化物对应水化物相互反应的离子方程式为:Al(OH)3 + OH— =AlO2— + 2H2O
点评:元素周期表是历年高考的重点和难点,综合考查元素在元素周期表的位置和性质,考生需要熟记元素周期表和掌握元素的性质,并且学会书写离子方程式和电子式,全面巩固基础知识。

练习册系列答案
相关题目