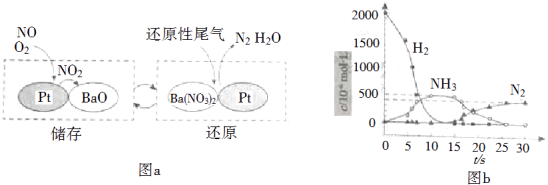
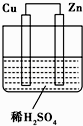
题目内容
【题目】根据要求完成题目.
(1)与氩原子电子层结构相同的﹣2价阴离子的结构示意图 .
(2)写出含有6个质子,8个中子的原子的化学符号是 .
(3)用“<”或“>”填空:A.酸性:H2SO4HClO4 , B.碱性:Ca(OH)2Ba(OH)2
(4)用电子式表示氯化镁的形成过程 .
【答案】
(1)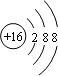
(2)614C
(3)<;<
(4)![]()
【解析】解:(1)与氩原子电子层结构相同的﹣2价阴离子应含有16个质子,原子核外有18个电子,为S2﹣,结构示意图为 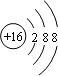 ,所以答案是:
,所以答案是: 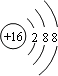 ;(2)含有6个质子,8个中子的原子为614C,所以答案是:614C;(3)非金属性Cl>S,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性H2SO4<HClO4,金属性Ba>Ca,金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性Ca(OH)2<Ba(OH)2,所以答案是:<,<;(4)氯化镁为离子化合物,由离子形成离子键,其形成过程为
;(2)含有6个质子,8个中子的原子为614C,所以答案是:614C;(3)非金属性Cl>S,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性H2SO4<HClO4,金属性Ba>Ca,金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性Ca(OH)2<Ba(OH)2,所以答案是:<,<;(4)氯化镁为离子化合物,由离子形成离子键,其形成过程为 ![]() ,所以答案是:
,所以答案是: ![]() .
.

练习册系列答案
相关题目