题目内容
(10分)X、Y、Z、W、V为前四周期常见的五种元素,其中四种为短周期元素。X原子核外电子数等于其电子层数;常温常压下,Y单质固体难溶于水而易溶于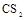 ;Z的氢化物在水中可完全电离出氢离子;W原子的电子层数是其价电子数的3倍;V的单质是一种应用最为广泛的金属。
;Z的氢化物在水中可完全电离出氢离子;W原子的电子层数是其价电子数的3倍;V的单质是一种应用最为广泛的金属。
请回答下列问题:
(1)写出实验室通过加热制备Z单质的离子方程式 ;
(2)W的两种常见氧化物中阳离子和阴离子个数比为2:1的是
(写化学式);
(3)写出X、Y、W三种元素组成的化合物的水溶液与Z单质反应的离子方程式 (可不配平);
(4)检验V的最高价简单离子常用的试剂是 ;
(5)将12gY单质完全燃烧的产物通入1OOmL1.2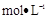 的氢氧化钠溶液中,所得溶液
的氢氧化钠溶液中,所得溶液
中含有的主要离子分别是
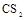 ;Z的氢化物在水中可完全电离出氢离子;W原子的电子层数是其价电子数的3倍;V的单质是一种应用最为广泛的金属。
;Z的氢化物在水中可完全电离出氢离子;W原子的电子层数是其价电子数的3倍;V的单质是一种应用最为广泛的金属。请回答下列问题:
(1)写出实验室通过加热制备Z单质的离子方程式 ;
(2)W的两种常见氧化物中阳离子和阴离子个数比为2:1的是
(写化学式);
(3)写出X、Y、W三种元素组成的化合物的水溶液与Z单质反应的离子方程式 (可不配平);
(4)检验V的最高价简单离子常用的试剂是 ;
(5)将12gY单质完全燃烧的产物通入1OOmL1.2
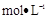 的氢氧化钠溶液中,所得溶液
的氢氧化钠溶液中,所得溶液中含有的主要离子分别是
(1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O(2分)
Mn2++Cl2↑+2H2O(2分)
(2)Na2O Na2O2(2分) (3)HS-+Cl2=H++S↓+2Cl-(可不配平)(2分)
(4)KSCN溶液(2分) (5)Na+、HSO-3(2分)
 Mn2++Cl2↑+2H2O(2分)
Mn2++Cl2↑+2H2O(2分)(2)Na2O Na2O2(2分) (3)HS-+Cl2=H++S↓+2Cl-(可不配平)(2分)
(4)KSCN溶液(2分) (5)Na+、HSO-3(2分)
X原子核外电子数等于其电子层数X原子核外电子数等于其电子层数,则X是H;常温常压下,Y单质固体难溶于水而易溶于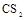 ,所以Y是S;Z的氢化物在水中可完全电离出氢离子,且Z是短周期元素,所以是Cl;W原子的电子层数是其价电子数的3倍,则W只能是Na。V的单质是一种应用最为广泛的金属,因此V是Fe。
,所以Y是S;Z的氢化物在水中可完全电离出氢离子,且Z是短周期元素,所以是Cl;W原子的电子层数是其价电子数的3倍,则W只能是Na。V的单质是一种应用最为广泛的金属,因此V是Fe。
(1)实验室制取氯气的方程式是MnO2+4H++2Cl- Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(2)钠的两种常见氧化物是Na2O、Na2O2。
(3)氯气极易强氧化性,而-2价的S具有还原性,所以反应的方程式是HS-+Cl2=H++S↓+2Cl-
(4)检验铁离子的常用试剂是KSCN溶液。
(5)12gS的物质的量是12g÷32g/mol=0.375mol,生成SO2也是0.375mol。氢氧化钠是0.1L×1.2mol/L=0.12mol,所以在反应中SO2是过量的,因此生产物是亚磷酸氢钠,主要离子是Na+、HSO-3。
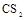 ,所以Y是S;Z的氢化物在水中可完全电离出氢离子,且Z是短周期元素,所以是Cl;W原子的电子层数是其价电子数的3倍,则W只能是Na。V的单质是一种应用最为广泛的金属,因此V是Fe。
,所以Y是S;Z的氢化物在水中可完全电离出氢离子,且Z是短周期元素,所以是Cl;W原子的电子层数是其价电子数的3倍,则W只能是Na。V的单质是一种应用最为广泛的金属,因此V是Fe。(1)实验室制取氯气的方程式是MnO2+4H++2Cl-
 Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。(2)钠的两种常见氧化物是Na2O、Na2O2。
(3)氯气极易强氧化性,而-2价的S具有还原性,所以反应的方程式是HS-+Cl2=H++S↓+2Cl-
(4)检验铁离子的常用试剂是KSCN溶液。
(5)12gS的物质的量是12g÷32g/mol=0.375mol,生成SO2也是0.375mol。氢氧化钠是0.1L×1.2mol/L=0.12mol,所以在反应中SO2是过量的,因此生产物是亚磷酸氢钠,主要离子是Na+、HSO-3。

练习册系列答案
相关题目
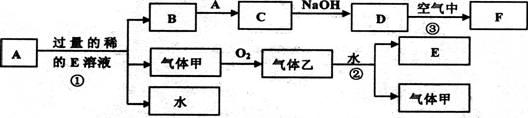
 学式:A ,C
学式:A ,C  是同主族元素,又知乙、丁两元素的原子核中质子数和是甲、丙原子核中质子数之和的2倍,甲元素的一种同位素核内无中子。
是同主族元素,又知乙、丁两元素的原子核中质子数和是甲、丙原子核中质子数之和的2倍,甲元素的一种同位素核内无中子。 。
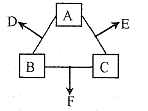
。
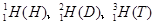 ,氯有2种核素:
,氯有2种核素: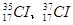 ,则HCl分子的相对分子质量数值可能有几种
,则HCl分子的相对分子质量数值可能有几种
 中充分燃烧所得氧化物的电子式________________
中充分燃烧所得氧化物的电子式________________ 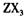 的浓溶液,现象为______________ ,
的浓溶液,现象为______________ , 基态离子的电子排布式为
基态离子的电子排布式为 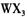 溶液为原料制取无水
溶液为原料制取无水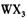 ,主要操作包括加热浓缩、冷却结晶、过滤,先制得
,主要操作包括加热浓缩、冷却结晶、过滤,先制得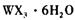 晶体,然后在条件下加热
晶体,然后在条件下加热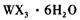 晶体,能进一步制取无水
晶体,能进一步制取无水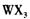 .其原因是(结合离子方程式简要说明) _____________________________________________
.其原因是(结合离子方程式简要说明) _____________________________________________