题目内容
18.已知A~I均为中学化学中的常见物质,它们之间的转化关系如图所示,其中A、D为金属单质,反应过程中需要或生成的水及其他部分产物已略去.请回答以下问题: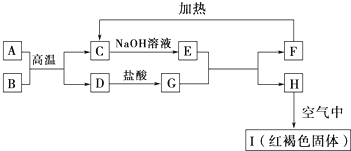
(1)F的化学式为Al(OH)3.
(2)E溶液中所有离子浓度由大到小的顺序是c(Na+)>c(AlO2-)>c(OH-)>c(H+).
(3)用离子反应方程式表示G溶液呈酸性的原因Fe2++2H2O?Fe(OH)2+2H+;该反应的平衡常数为1.25×10-13(已知常温下,H的溶度积常数Ksp=8.0×10-16).
分析 A、D是常见的金属单质,考虑为铝热反应,而转化得到I为红褐色固体,则I为Fe(OH)3,结合转化关系可知,B为Fe2O3,A为Al,D为Fe,C为Al2O3,则G为FeCl2、E为NaAlO2、H为Fe(OH)2、F为Al(OH)3,据此解答.
解答 解:A、D是常见的金属单质,考虑为铝热反应,而转化得到I为红褐色固体,则I为Fe(OH)3,结合转化关系可知,B为Fe2O3,A为Al,D为Fe,C为Al2O3,则G为FeCl2、E为NaAlO2、H为Fe(OH)2、F为Al(OH)3,
(1)由上述分析可知,F为Al(OH)3,故答案为:Al(OH)3;
(2)NaAlO2溶液中,偏铝酸根水解,溶液呈碱性,所有离子浓度由大到小的顺序是:c(Na+)>c(AlO2-)>c(OH-)>c(H+),故答案为:c(Na+)>c(AlO2-)>c(OH-)>c(H+);
(3)FeCl2溶液中亚铁离子水解:Fe2++2H2O?Fe(OH)2+2H+,溶液呈酸性,平衡常数K=$\frac{{c}^{2}({H}^{+})}{c(F{e}^{2+})}$,Ksp=c2(OH-)×c(Fe2+),故K×Ksp=(Kw)2,则K=$\frac{(1{0}^{-14})^{2}}{8×1{0}^{-16}}$=1.25×10-13,
故答案为:Fe2++2H2O?Fe(OH)2+2H+;1.25×10-13.
点评 本题考查无机物推断,涉及盐类水解、平衡常数计算、Al及Fe元素单质化合物的性质,物质的颜色是推断突破口,需要学生熟练掌握元素化合物知识,(3)为易错点、难点,难度中等.

练习册系列答案
相关题目
9.下列说法正确的是( )
| A. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| B. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| C. | 常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA | |
| D. | 在H2O2+Cl2=2HCl+O2反应中,每生成32g 氧气,转移2NA个电子 |
6.下列与处理方法对应的反应方程式不正确的是( )
| A. | 工业上用水吸收NO2生产硝酸:3NO2+H2O═2HNO3+NO | |
| B. | 用氨水除去工业原料氯化铵中的氯化铁杂质:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 用熟石灰处理泄漏的液氯:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O | |
| D. | 用明矾除去水中的悬浮颗粒物:Al3++3H2O?Al(OH)3 (胶体)+3H+ |
13.(1)镍氢碱性充电电池被誉为“绿色化学电源”,充、放电时的反应:2Ni(OH)2 $?_{放电}^{充电}$2NiO(OH)+H2.放电时,正极的电极反应式为NiOOH+e-+H2O=Ni(OH)2+OH-,充电时,该电极应与电源的正(填“正”或“负”)极相连.
(2)氨在空气中燃烧,生成水和氮气.已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,2H2(g)+O2(g)═2H2O(l)△H=-572kJ•mol-1.则氨在空气中燃烧生成液态水和氮气时的热化学方程式为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l);△H=-1531.2kJ•mol-1.
(3)研究表明工业上合成氨反应(N2(g)+3H2(g)?2NH3(g))在容积固定的密闭容器中发生上述反应,表中为各物质在不同时刻的浓度.
0~5min,H2的平均反应速率vH2=0.072mol/(L•min).反应在5分钟时,条件发生了改变,改变的条件可能是c(填序号).
a.增加氢气的浓度 b.降低温度 c.使用催化剂 d.分离出NH3.
(2)氨在空气中燃烧,生成水和氮气.已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,2H2(g)+O2(g)═2H2O(l)△H=-572kJ•mol-1.则氨在空气中燃烧生成液态水和氮气时的热化学方程式为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l);△H=-1531.2kJ•mol-1.
(3)研究表明工业上合成氨反应(N2(g)+3H2(g)?2NH3(g))在容积固定的密闭容器中发生上述反应,表中为各物质在不同时刻的浓度.
| 时间/min | C(N2)/mol.L-1 | C(H2)/mol.L-1 | C(NH3)/mol.L-1 |
| 0 | 0.6 | 1.8 | 0 |
| 5 | 0.48 | X | 0.24 |
| 10 | 0.26 | 0.78 | 0.68 |
a.增加氢气的浓度 b.降低温度 c.使用催化剂 d.分离出NH3.
10.下列实验操作中正确的是( )
| A. | 应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 分液操作时,下层液体从分液漏斗下口放出后再将上层液体从下口放出到另一个烧杯中 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
7.价电子排布式为5s25p3的元素是( )
| A. | 第五周期第ⅢA族 | B. | 51号元素 | C. | sp区的主族元素 | D. | Te |
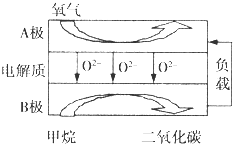 甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.
甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.