题目内容
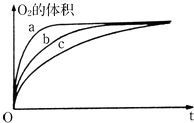
【题目】如图表示反应X(g)4Y(g)+Z(g),在 200℃和a℃时,X的浓度随时间变化的曲线 
(1)200℃时,5min内用Y表示平均反应速率 .
(2)200℃在8min时,Z的浓度为 .
(3)200℃在时刻,反应达到平衡.
(4)200℃时,第7min时刻,V(正)V(逆)(填“>”、“<”、“=”).
(5)从图中可以看出,200(填“>”、“<”、“=”).
【答案】
(1)0.64mol?L﹣1?min﹣1
(2)0.85mol?L﹣1
(3)6min
(4)=
(5)>
【解析】解:(1)5min内X浓度变化为1.0mol/L﹣0.2mol/L=0.8mol/L,v(X)= ![]() =0.016molL﹣1min﹣1 , v(Y)=4×0.016molL﹣1min﹣1=0.64molL﹣1min﹣1 , 所以答案是:0.64molL﹣1min﹣1;(2)X与Z计量数之比为1:1,则Z的浓度与X的消耗浓度相等,即c(Z)=△c(X)=0.85mol/L,所以答案是:0.85mol/L;(3)X的浓度不再发生变化时,达到化学平衡状态,第6min时,X浓度不再变化,所以答案是:6min;(4)7min达到化学平衡状态,V(正)=V(逆),所以答案是:V(正)=V(逆);(5)温度越高,化学反应速率越快,达到化学平衡时间越短,图象中a℃先达到平衡状态,故a>200,所以答案是:>.
=0.016molL﹣1min﹣1 , v(Y)=4×0.016molL﹣1min﹣1=0.64molL﹣1min﹣1 , 所以答案是:0.64molL﹣1min﹣1;(2)X与Z计量数之比为1:1,则Z的浓度与X的消耗浓度相等,即c(Z)=△c(X)=0.85mol/L,所以答案是:0.85mol/L;(3)X的浓度不再发生变化时,达到化学平衡状态,第6min时,X浓度不再变化,所以答案是:6min;(4)7min达到化学平衡状态,V(正)=V(逆),所以答案是:V(正)=V(逆);(5)温度越高,化学反应速率越快,达到化学平衡时间越短,图象中a℃先达到平衡状态,故a>200,所以答案是:>.

【题目】(1)下列各组分子中,属于含极性键的非极性分子的是 _______________
BF3 、 H2S 、 CH3Cl 、 NH3 、 CS2、 C60、 C2H4 、 HCl
(2)按所示格式填写下表中的空格:
原子序数 | 原子的价电子排布式 | 周期 | 族 |
17 | ①______ | 第三 | ②______ |
③______ | 3d54s1 | ④______ | ⅥB |
(3)在配离子[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是______,配离子 [Cu(NH3)4]2+中提供孤对电子的原子是_______________。
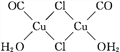
(4)镍的羰基配合物Ni(CO)4是获得高纯度纳米镍的原料,该配合物中镍原子的的价电子排布式为3d10,则其杂化轨道类型为____,Ni(CO)4是_____(填“极性”或“非极性”)分子。
(5)氯化亚铜是一种白色固体,实验测得其蒸气密度是同条件下氢气密度的99.5倍,则氯化亚铜的分子式为____;氯化亚铜的盐酸溶液可定量吸收CO形成配合物Cu2(CO)2Cl2·2H2O(结构如图所示),该反应可用于测定空气中CO的含量,每个Cu2(CO)2Cl2·2H2O分子中含有____个配位键,____个σ键。