题目内容
【题目】数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果。如利用CO2和CH4重整可制合成气(主要成分为CO、H2),已知重整过程中部分反应的热化学方程式为:
I、CH4(g)=C(s)+2H2(g) △H=+75.0kJ·mol-1
II、CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41.0kJ·mol-1
III、CO(g)+H2(g)=C(s)+H2O(g) △H=-131.0kJ·mol-1
(1)反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H = kJ·mol-1。
(2)固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图甲。


①同温度下CO2的平衡转化率 (填“大于”或“小于”)CH4的平衡转化率,其原因是 。
②高温下进行该反应时常会因反应I生成“积碳”(碳单质),造成催化剂中毒,高温下反应I能自发进行的原因是 。
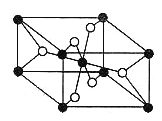
(3)一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图乙所示,该反应的化学方程式为 。
(4)CO常用于工业冶炼金属,右图是在不同温度下CO还原四种金属氧化物达平衡后气体中lg[c(CO)/c(CO2)]与温度(t)的关系曲线图。下列说法正确的是 。
A.工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量
B.CO不适宜用于工业冶炼金属铬(Cr)
C.工业冶炼金属铜(Cu)时较低的温度有利于提高CO的利用率
D.CO还原PbO2的反应ΔH>0
(5)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2![]() 2CO+O2,则其阳极的电极反应式为 。
2CO+O2,则其阳极的电极反应式为 。
【答案】
(1)247
(2)①大于;CO2发生了其他副反应;②△S>0
(3)CO2+4H2![]() CH4+2H2O
CH4+2H2O
(4)BC(5)4OH--4e-=O2↑+2H2O
【解析】
试题分析:(1)已知:①CH4(g)═C(s)+2H2(g)△H=+75.0kJ/mol,②CO2(g)+H2(g)═CO(g)+H2O(g) △H=+41.0kJ/mol,③CO(g)+H2(g)═C(s)+H2O(g)△H=-131.0kJ/mol,反应CO2(g)+CH4(g)═2CO(g)+2H2(g)可以是①+②-③得到,根据盖斯定律计算反应的焓变△H=+247kJ/mol,故答案为:+247;
(2)①根据图示可以看出,CO2发生了其他副反应,同温度下CO2的平衡转化率大于CH4的平衡转化率大于;故答案为:大于;CO2发生了其他副反应;
②反应自发进行的判据:△H-T△S<0,反应①△S>0,△H>0,代入判据,得到反应在高温下能自发进行,故答案为:△S>0;
(3)据信息:一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”,可以写出方程式为:CO2+4H2![]() CH4+2H2O,故答案为:CO2+4H2
CH4+2H2O,故答案为:CO2+4H2![]() CH4+2H2O;
CH4+2H2O;
(4)A、增高炉的高度,增大CO与铁矿石的接触,不能影响平衡移动,CO的利用率不变,故A错误;B、由图象可知用CO工业冶炼金属铬时,lg[c(CO)/c(CO2)]一直很高,说明CO转化率很低,故不适合B正确;C、由图象可知温度越低lg[c(CO)/c(CO2)]越小,故CO转化率越高,故C正确;D、由图象可知CO还原PbO2的温度越高lg[c(CO)/c(CO2)]越高,说明CO转化率越低,平衡逆向移动,故△H<0,故D错误;故选:BC;
(5)以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2![]() 2CO+O2,则溶液中的氢氧根在阳极上失去电子发生氧化反应生成氧气,的电极反应式为:4OH--4e-=O2↑+2H2O;故答案为:4OH--4e-=O2↑+2H2O。
2CO+O2,则溶液中的氢氧根在阳极上失去电子发生氧化反应生成氧气,的电极反应式为:4OH--4e-=O2↑+2H2O;故答案为:4OH--4e-=O2↑+2H2O。