题目内容
【题目】I.(1)电化学降解NO3-的原理如图1所示,电源正极为_____ (填“a”或“b”); 阴极电极反应式为____.

Ⅱ.工业上利用合成气(主要成分为CO、CO2和H2) 在催化剂的作用下合成甲醇。已知298K 和101KPa 条件下:
2H2(g)+O2(g)= 2H2O(1) ΔH1= -571.6kJ/mol
CO(g)+1/2O2(g)= CO2(g) ΔH2= -283.0kJ/mol
CH3OH(1)+3/2O2(g)=CO2(g) +2H2O(1) ΔH3= -726.5kJ/mol
(2)则CO(g)+2H2 (g) ![]() CH3OH(1) ΔH=____kJ/mol
CH3OH(1) ΔH=____kJ/mol
(3)已知:CH3OH(1) =CH3OH(g) ΔH=+35.2kJ/mol;
CO(g)+2H2(g) ![]() CH3OH(g)平衡常数K 随温度变化关系的曲线为图2 中的______(填曲线标记字母Ⅰ或II)。
CH3OH(g)平衡常数K 随温度变化关系的曲线为图2 中的______(填曲线标记字母Ⅰ或II)。

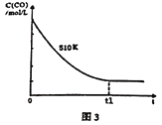
(4)维持反应温度为510K,以n(H2)/n(CO)=2:1充入一定量的原料气于1 L容器中,在上述条件下充分反应,t1时刻达到平衡测得容器中c(CH3OH)=2mol/L.则平衡时CO 转化率=______;若维持反应温度为520K,其它条件不变,请在图3中画出c(CO)在0~t1时刻变化曲线。__________________
(5)20世纪90年代,化学家研制出新型催化剂: 碱金属的醇盐及溶剂用于合成甲醇。图4是在该新型催化剂作用下,研究温度、压强对合成甲醇的影响。由图可知适宜的反应温度、压强分别为_____ (填字母)。
温度A.90-150℃ B.200-260℃ C.300-360℃ D.400-460℃
压强E.0.1~1MPa F.3~5 MPa G.8~10MPa H.15~20MPa

【答案】 a 2NO3-+12H++10e-=N2+6H2O ΔH=-128.1kJ/mol I 97.56% (或97.6%或98%)  A、F
A、F
【解析】I.(1)硝酸根离子得电子生成氮气,则b相连的电极为阴极,所以b为负极,a为正极,阴极上的反应为:2NO3-+10e-+12H+=6H2O+N2↑;故答案为:a;2NO3-+10e-+12H+=6H2O+N2↑;
Ⅱ. (2) ①2H2(g)+O2(g)= 2H2O(1) ΔH1= -571.6kJ/mol,②CO(g)+ ![]() O2(g)= CO2(g) ΔH2= -283.0kJ/mol,③CH3OH(1)+3/2O2(g)=CO2(g) +2H2O(1) ΔH3= -726.5kJ/mol,根据盖斯定律,将①+②-③得:CO(g)+2H2 (g)
O2(g)= CO2(g) ΔH2= -283.0kJ/mol,③CH3OH(1)+3/2O2(g)=CO2(g) +2H2O(1) ΔH3= -726.5kJ/mol,根据盖斯定律,将①+②-③得:CO(g)+2H2 (g) ![]() CH3OH(1) ΔH=(-571.6kJ/mol)+(-283.0kJ/mol)- (-726.5kJ/mol)=-128.1kJ/mol,故答案为:-128.1;
CH3OH(1) ΔH=(-571.6kJ/mol)+(-283.0kJ/mol)- (-726.5kJ/mol)=-128.1kJ/mol,故答案为:-128.1;
(3) ①CO(g)+2H2 (g) ![]() CH3OH(1) ΔH=-128.1kJ/mol,②CH3OH(1) =CH3OH(g) ΔH=+35.2kJ/mol;根据盖斯定律,①+②得,CO(g)+2H2(g)
CH3OH(1) ΔH=-128.1kJ/mol,②CH3OH(1) =CH3OH(g) ΔH=+35.2kJ/mol;根据盖斯定律,①+②得,CO(g)+2H2(g) ![]() CH3OH(g) ΔH=-92.9 kJ/mol,升高温度,平衡逆向移动,平衡常数K减小,因此平衡常数K 随温度变化关系的曲线为图2 中的I,故答案为:I;
CH3OH(g) ΔH=-92.9 kJ/mol,升高温度,平衡逆向移动,平衡常数K减小,因此平衡常数K 随温度变化关系的曲线为图2 中的I,故答案为:I;
(4)设开始时充入的氢气和一氧化碳的物质的量分别为2x,x,
CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
开始(mol/L) x 2x 0
反应(mol/L) 2 4 2
平衡(mol/L) x-2 2x-4 2
510K时K=4×103,则![]() =4×103,解得x=2.05mol,CO 转化率=
=4×103,解得x=2.05mol,CO 转化率=![]() ×100%=97.56%;若维持反应温度为520K,温度升高,平衡逆向移动,平衡是CO的浓度增大,建立平衡需要的时间减少,图像为
×100%=97.56%;若维持反应温度为520K,温度升高,平衡逆向移动,平衡是CO的浓度增大,建立平衡需要的时间减少,图像为 ,故答案为:97.56%;
,故答案为:97.56%; ;
;
(5)根据反应方程式CO(g)+2H2(g) ![]() CH3OH(g) ΔH=-92.9 kJ/mol,温度越高,CO的转化率越低,压强越大,CO的转化率越大;根据图像,温度在90-150℃左右,压强在3~5 MPa时,CO的转化率已经较高,再增大压强,对设备的要求增大,成本升高,故选AF。
CH3OH(g) ΔH=-92.9 kJ/mol,温度越高,CO的转化率越低,压强越大,CO的转化率越大;根据图像,温度在90-150℃左右,压强在3~5 MPa时,CO的转化率已经较高,再增大压强,对设备的要求增大,成本升高,故选AF。

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】请按要求填写下列空白:
主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在元素①②⑤⑥⑦⑧对应的最高价氧化物的水化物中,碱性最强的化合物的电子式是:_________________________________________;
(2)写出元素②的最简单氢化物的结构式_________________________;
(3)④⑤⑥⑦四种元素的简单离子半径从大到小排序____________(用离子符号表示);
(4)写出元素⑥的最高价氧化物与元素⑤的最高价氧化物的水化物反应的离子方程式______;
(5)写出元素③的常见氢化物和它的最高价氧化物的水化物反应的化学方程式____________。





