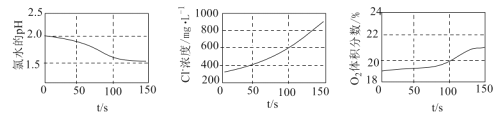
题目内容
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
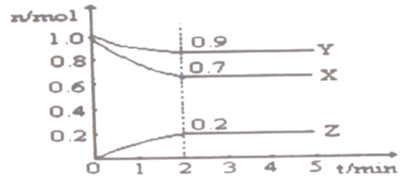
(1)该反应的化学方程式为____
(2)反应开始至2min,以Z表示的平均反应速率为____
(3)该反应为放热反应,能使该反应的反应速率增大的是____
A.及时分离出Z气体 B.适当降低温度 C.增大Y的浓度 D.选择高效催化剂
(4)2min后反应达到平衡,此时容器内混合气体的平均相对分子质量比起始投料时____(填“增大”“减小”或“相等”)
(5)可以判断上述反应已经达到平衡的是____
A.密闭容器中总压强不变
B.密闭容器中混合气体的密度不变
C.混合气体的平均相对分子质量不再改变
D.n(A):n(B):n(C)等于化学计量系数之比
【答案】3X+Y2Z 0.05mol/(Lmin) CD 增大 AC
【解析】
根据图示信息判断反应物、生成物,根据公式![]() 计算化学反应速率,由影响化学反应速率的外因分析解答,根据条件是否为变量判断反应是否达到平衡状态。
计算化学反应速率,由影响化学反应速率的外因分析解答,根据条件是否为变量判断反应是否达到平衡状态。
(1)根据图像可知X和Y的物质的量减少,是反应物,Z的物质的量增加,是生成物,变化量之比是0.3:0.1:0.2=3:1:2,因此该反应的化学方程式为3X+Y2Z;
(2)反应开始至2 min,以气体Z表示的平均反应速率为![]() =0.05mol/(Lmin);
=0.05mol/(Lmin);
(3)A.及时分离出Z气体,浓度降低,化学反应速率减小,A不选;
B.适当降低温度,反应速率降低,B不选;
C.增大Y的浓度,活化分子数增多,化学反应速率加快,C选;
D.选择高效催化剂,降低了反应的活化能,化学反应速率加快,D选;
答案选CD;
(4)正反应体积减小,气体质量不变,因此达平衡时,容器内混合气体的平均相对分子质量比起始投料时增大;
(5)A.正反应体积减小,密闭容器中总压强不变,说明反应达到平衡状态,A正确;
B.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此密闭容器中混合气体的密度不变不能说明达到平衡状态,B错误;
C.混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以混合气体的平均相对分子质量不再改变说明反应达到平衡状态,C正确;
D.n(A):n(B):n(C)等于化学计量系数之比不能说明正逆反应速率相等,不一定处于平衡状态,D错误;
答案选AC。

 阅读快车系列答案
阅读快车系列答案