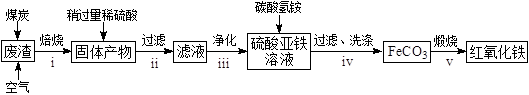
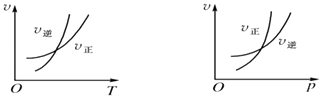题目内容
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成。已知NOCl是一种红褐色液体或黄色气体,其熔点64.5℃,沸点5.5℃,遇水易水解。
(1)实验室制备原料气NO和Cl2的装置如下图所示: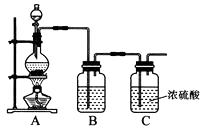
①实验室制NO时,装置A中烧瓶内发生反应的化学方程式为。
②实验室制Cl2时,装置B中盛放的试剂为 , 其作用是。
(2)将上述收集到的Cl2充入集气瓶中,按图示装置制备亚硝酰氯。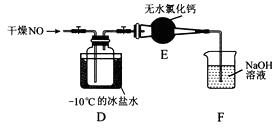
①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为。
②装置D中的现象为。
③装置E中无水氯化钙的作用为。
④某同学认为装置F不能吸收NO,为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是。
(3)NO可用间接电化学法除去,其原理如下图所示:
①阴极的电极反应式为。
②吸收塔内发生反应的离子方程式为。
【答案】
(1)①3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O;饱和食盐水;除去 Cl2中的HCl气体
(2)![]() ;黄绿色气体颜色逐渐变浅,有红褐色液体生成;吸收水蒸气,防止水蒸气进入D装置;O2
;黄绿色气体颜色逐渐变浅,有红褐色液体生成;吸收水蒸气,防止水蒸气进入D装置;O2
(3)2HSO3?+2H++2e?==S2O42?+2H2O;2NO+2S2O42?+2H2O==N2+4HSO3?
【解析】解(1)①实验室采用铜与稀硝酸反应制取NO气体,所以气体发生装置A中烧瓶内发生反应的化学方程式为: 3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O。②实验室制得的氯气中混有HCl气体,所以装置B中应盛放饱和食盐水,目的是除去HCl气体,然后再通过浓硫酸干燥得到纯净干燥的氯气。(2)①根据原子的最外层电子数判断,N、O、Cl三种原子若要满足8电子稳定结构,需分别共用3对、2对和1对电子,所以它们通过共用电子对形成共价化合物时,氮原子与氧原子共用2对电子,与氯原子共用1对电子,其电子式为 ![]() 。②氯气为黄绿色,随着反应的进行,氯气不断消耗,则气体颜色变浅,集气瓶浸入-10℃的冰盐水中,此时生成的NOCl为液体,故。装置中看到的现象为:黄绿色气体颜色逐渐变浅,有红褐色液体生成。③因为NOCl遇水易水解,所以应在无水环境中制备,设备E装置的目的就是吸收水蒸气,防止水蒸气进入D装置。④NO不能被氢氧化钠溶液吸收,但通入O2后即可被吸收,吸收反应的化学方程式为:4NO+3O2+4NaOH=4NaNO3+2H2O。(3)①电解时阴极发生还原反应,从原理示意图中物质的箭头指向可知,阴极区HSO3得电子生成S2O42 , 故阴极的电极反应式为2HSO3+2H++2e==S2O42+2H2O②从图示可知,吸收塔内发生的反应,NO和S2O42为反应物,N2和HSO3为生成物,配平后的离子方程式为2NO+2S2O42+2H2O==N2+4HSO3。
。②氯气为黄绿色,随着反应的进行,氯气不断消耗,则气体颜色变浅,集气瓶浸入-10℃的冰盐水中,此时生成的NOCl为液体,故。装置中看到的现象为:黄绿色气体颜色逐渐变浅,有红褐色液体生成。③因为NOCl遇水易水解,所以应在无水环境中制备,设备E装置的目的就是吸收水蒸气,防止水蒸气进入D装置。④NO不能被氢氧化钠溶液吸收,但通入O2后即可被吸收,吸收反应的化学方程式为:4NO+3O2+4NaOH=4NaNO3+2H2O。(3)①电解时阴极发生还原反应,从原理示意图中物质的箭头指向可知,阴极区HSO3得电子生成S2O42 , 故阴极的电极反应式为2HSO3+2H++2e==S2O42+2H2O②从图示可知,吸收塔内发生的反应,NO和S2O42为反应物,N2和HSO3为生成物,配平后的离子方程式为2NO+2S2O42+2H2O==N2+4HSO3。

【题目】环己酮(如图1)是一种重要的化工原料,实验室常用下列原理和装置制备(部分夹持仪器未画出)(如图2):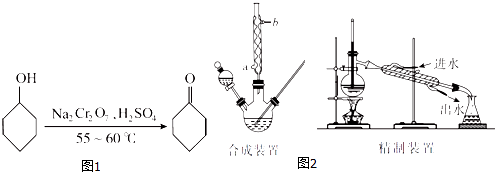
环己醇、环己酮和水的部分物理性质见下表(*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点):
物质 | 相对分子质量 | 沸点(℃) | 密度(gcm﹣3 , 20℃) | 溶解性 |
环己醇 | 100 | 161.1(97.8) | 0.9624 | 能溶于水 |
环己酮 | 98 | 155.6(95) | 0.9478 | 微溶于水 |
水 | 18 | 100.0 | 0.9982 |
(1)已知合成环己酮的反应是放热反应,反应剧烈将导致体系温度迅速上升,副反应增多.实验时,先在合成装置中加入5.2 mL(5 g)环己醇和几粒沸石,再加入酸性Na2Cr2O7溶液.酸性Na2Cr2O7溶液的加料方式为(填代号).
A.一次性加入
B.缓慢加入
C.无所谓,怎样加入都可以
(2)若酸性Na2Cr2O7溶液的体积为35 mL,则应选取(填“100 mL”或“250mL”)的三颈瓶.
(3)反应完成后,加入适量水,蒸馏,收集95~100℃的馏分(设为A),其主要成分是的混合物.
(4)合成装置中冷凝管的作用是 , 冷凝水从冷凝管的(填“a”或“b”)口进入.
(5)在馏分A中加入氯化钠固体至饱和,振荡、静置、分液,得有机层(设为B).加入氯化钠固体的作用是 .
(6)在有机层B中加入无水硫酸镁固体,除去其中的少量水分.过滤,将滤液置于精制装置中蒸馏,收集(填代号)的馏分,得到纯净的环己酮.
A.100.0~102.0℃
B.154.0~156.0℃
C.160.0~162.0℃
(7)精制装置中的错误是 . (任写一点)
(8)若最终得到环己酮的质量为3.43 g,则环己酮的产率是 .