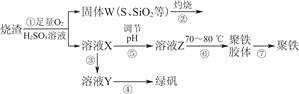
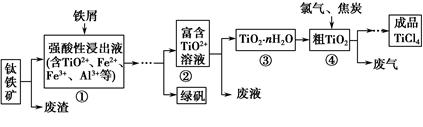
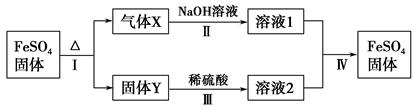
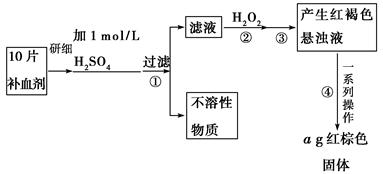
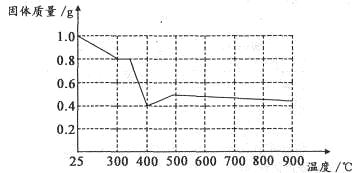
题目内容
钓鱼岛群岛的东海海域及部分太平洋海域探明为海底热水矿床。海底热水矿床是沉积着由岩浆热气从地底喷出的金、铜、锌、稀有金属等区域。下列说法正确的是( )。
| A.金不溶于任何溶液 |
| B.铜、锌在空气中均能被氧化成对应的氧化物 |
| C.铜锌合金的熔点低于铜或锌的熔点 |
D.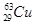 的质子数和中子数之差为34 的质子数和中子数之差为34 |
C
金能够溶于王水,A项错误;铜在空气中被腐蚀生成铜锈,主要成分是Cu2(OH)2CO3,B项错误;合金的熔点一般比成分金属的都低,C项正确;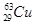 的质子数和中子数之差为(63-29)-29=5,D项错误。
的质子数和中子数之差为(63-29)-29=5,D项错误。
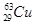 的质子数和中子数之差为(63-29)-29=5,D项错误。
的质子数和中子数之差为(63-29)-29=5,D项错误。
练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目