题目内容
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一元素。根据表中所列元素回答下列问题:

(1)元素d在周期表中的位置是_____________,h与f原子序数相差______________。
(2)b、c、f的简单离子半径最小的是___________(填离子符号),原子半径最小的是______(填化学式)。
(3)表中第三周期元素的非金属性最强是_________(用元素符号表示), e、f、g三种元素的气态氢化物最不稳定的是__________(用化学式表示)。
(4)g元素与b元素的最高价氧化物对应水化物反应的化学方程式为________________________。
【答案】(1)第三周期IIIA族(2分),18(2分)。(2)Mg2+(1分),S(1分)。
(3)Cl(1分),PH3(1分)(4)NaOH+HClO4=NaClO4+H2O(2分)。
【解析】试题分析:根据元素在周期表中的位置可知a是N,b是Na,c是Mg,d是Al,e是P,f是S,g是Cl,h是Se。
(1)元素Al在周期表中的位置是第三周期IIIA族,h与f原子序数相差34-16=18。
(2)核外电子排布相同的离子,离子半径随原子序数的增大而减小,离子的核外电子层数越多,离子半径越大,则b、c、f的简单离子半径最小的是Mg2+。同周期自左向右原子半径逐渐减小,则原子半径最小的是S。
(3)表中第三周期元素的非金属性最强是Cl。同周期自左向右非金属性逐渐增强,氢化物稳定性逐渐增强,则e、f、g三种元素的气态氢化物最不稳定的是PH3。
(4)g元素与b元素的最高价氧化物对应水化物反应的化学方程式为NaOH+HClO4=NaClO4+H2O。

【题目】完成下列问题。
Ⅰ.已知甲和乙为中学常见金属单质,丙和丁为常见气体单质,A~E为常见化合物;A为淡黄色固体,常温下B为液体,C的焰色反应为黄色。试回答下列问题:
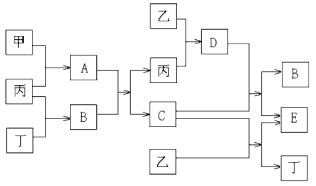
(1)A和E的化学式分别为____________、_____________;
(2)A+B → C+丙的化学方程式:____________________________;
(3)D+C → B+E的离子方程式:________________________________;
(4)1 mol甲和1 mol乙混合投入到足量的B中,在标准状况下,最多能产生________L丁气体。
Ⅱ.在标准状况下,取甲、乙、丙各30mL相同浓度的盐酸,然后分别慢慢加入组成相同的铝镁混合物,得下表中有关数据(反应前后溶液体积不发生变化)。
实验序号 | 甲 | 乙 | 丙 |
混合物质量/mg | 255 | 385 | 459 |
气体体积/mL | 280 | 336 | 336 |
(1)甲组实验中,盐酸__________(填“过量”、“适量”或“不足”);
乙组实验中,盐酸__________(填“过量”、“适量”或“不足”)。
(2)盐酸的物质的量的浓度为_____________mol/L。
(3)混合物中Mg和Al的物质的量之比为___________。