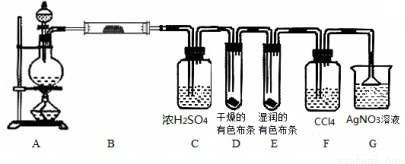
题目内容
从海水中提取镁的工业生产流程如下:
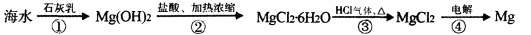
下列说法错误的是
A.此法的优点之一是原料来源丰富
B.该提取镁的过程中涉及置换、分解、复分解和氧化还原反应
C.步骤①②③的目的是从海水中提取无水MgCl2
D.步骤②中加盐酸的离子方程式为Mg(OH)2+2H+=Mg2++2H2O
B
【解析】
试题分析:CaCO3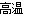 CaO+CO2,CaO+H2O=Ca(OH)2, Ca(OH)2+MgCl2= CaCl2+Mg(OH)2↓, Mg(OH)2+2HCl= 2H2O +MgCl2, MgCl2
CaO+CO2,CaO+H2O=Ca(OH)2, Ca(OH)2+MgCl2= CaCl2+Mg(OH)2↓, Mg(OH)2+2HCl= 2H2O +MgCl2, MgCl2 Mg+Cl2↑. A.此法的优点之一是原料贝壳、海水来源丰富。正确。B.该提取镁的过程中并未涉及置换反应,错误。 C.步骤①②③的目的是从海水中提取无水MgCl2,正确。 D.步骤②中加盐酸的离子方程式为Mg(OH)2+2H+=Mg2++2H2O,正确。
Mg+Cl2↑. A.此法的优点之一是原料贝壳、海水来源丰富。正确。B.该提取镁的过程中并未涉及置换反应,错误。 C.步骤①②③的目的是从海水中提取无水MgCl2,正确。 D.步骤②中加盐酸的离子方程式为Mg(OH)2+2H+=Mg2++2H2O,正确。
考点:考查以贝壳、海水为原料制备Mg的化学反应原理的知识。

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目