题目内容
在一定温度下,反应:2A(s)+2B(g)  C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是
C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是
 C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是
C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是 | A.单位时间内生成2a mol B,同时生成a molD |
| B.C的质量不再改变 |
| C.容器内的压强不随时间而变化 |
| D.混合气体的密度不再随时间而变化 |
C
试题分析:对于一个可逆反应,达到化学平衡,说明正反应速率与逆反应速率相等。且各物质的浓度保持不变,A选项如果从速率来判断一个反应是否达到平衡,需要有正的反应方向和逆的反应方向,且生产和消耗的反应速率要等于化学计量数。单位时间内生成2a mol B,反应方向为逆反应方向,,生成a molD,反应方向为正反应方向,且比例关系是按化学计量数进行的,因此A选项是能说明该反应已达到化学平衡状态的。B选项C的质量不再改变,说明其他物质的质量也是不变的,因此B选项也是正确的。C选项。左边反应物的气体量为2,右边生成物的气体量也为2.说明在任何的情况下,容器内的压强都是不会发生变化的,所以C选项是错误的。D选项,密度等于质量处于体积,据质量守恒定律可知,反应前后物质的总质量不变,而反应物中,有固体物质,因为如果反应向正反应方向进行的时候,气体的质量增大,反应向逆反应方向进行的时候,气体的质量减小,而反应前后气体的体积不变,气体质量的改变必定会造成气体密度的改变,因为如果混合气体的密度不再随时间而变化说明个物质的浓度保持不变,所以D选项是正确的。

练习册系列答案
相关题目
 3C(g),在一定条件下,使一定量A和B气体反应,达到平衡状态时,具有的关系是
3C(g),在一定条件下,使一定量A和B气体反应,达到平衡状态时,具有的关系是 HBr+HBrO,下列措施,不能使溶液颜色变浅的是
HBr+HBrO,下列措施,不能使溶液颜色变浅的是  2C(气)达到平衡的标志是( )
2C(气)达到平衡的标志是( ) 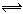 2AB(g) ,反应达到平衡状态的标志是
2AB(g) ,反应达到平衡状态的标志是