题目内容
[化学一选修3:物质结构与性质]在A、B、C三种元素中,A元素原子的价电子排布为2s22p5素K、L能层上的电子数与M、N层上的电子数相同.C元素的原子序数等于A、B两元素原子序数之和,C的单质在生产生活中具有许多用途,它可在硫酸铜溶液中用电解法进行精炼.请回答以下问题:
(1)已知C元素的电负性数值为1.9,则A、C两元素的原子之间应形成 键(填“共价”或“离子”);
(2)C元素的价电子排布式为 ;
(3)在A元素氢化物的水溶液中,存在有 种不同类型的氢键;
(4)SO
原子的杂化轨道类型是 ,SO
体构型是 ;
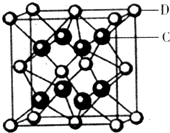
(5)一种铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为 ;该晶体中,原子之间的作用力是 ;
(6)在A、B两元素所形成晶体的晶胞中,位于六面体顶点和面心上的元素为 (填具体的元素符号).
(1)已知C元素的电负性数值为1.9,则A、C两元素的原子之间应形成
(2)C元素的价电子排布式为
(3)在A元素氢化物的水溶液中,存在有
(4)SO
2- 4 |
2- 4 |
(5)一种铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为
(6)在A、B两元素所形成晶体的晶胞中,位于六面体顶点和面心上的元素为
分析:在A、B、C三种元素中,A元素原子的价电子排布为2s22p5,则A氟元素;B元素K、L能层上的电子数与M、N层上的电子数相同,则B原子核外电子数为(2+8)×2=20,故B为Ca元素;C元素的原子序数等于A、B两元素原子序数之和,则C为Cu元素,
(1)一般情况,电负性之差大于1.7形成离子键,小于1.7形成共价键;
(2)Cu为29号元素,根据核外电子排布规律书写价电子排布式;
(3)HF溶液中,HF分子之间、水分子之间都存在氢键,HF与水分子之间存在2种形式氢键;
(4)计算S原子的价层电子数与孤电子对数,据此判断杂化方式与空间结构;
(5)根据均摊法计算晶胞中Cu、Au原子数目,确定合金中二者原子数目之比;铜金合金晶体属于金属晶体,据此判断化学键类型;
(6)A、B两元素所形成晶体为CaF2,晶胞中钙离子处于顶点与面心上、氟离子处于晶胞内部.
(1)一般情况,电负性之差大于1.7形成离子键,小于1.7形成共价键;
(2)Cu为29号元素,根据核外电子排布规律书写价电子排布式;
(3)HF溶液中,HF分子之间、水分子之间都存在氢键,HF与水分子之间存在2种形式氢键;
(4)计算S原子的价层电子数与孤电子对数,据此判断杂化方式与空间结构;
(5)根据均摊法计算晶胞中Cu、Au原子数目,确定合金中二者原子数目之比;铜金合金晶体属于金属晶体,据此判断化学键类型;
(6)A、B两元素所形成晶体为CaF2,晶胞中钙离子处于顶点与面心上、氟离子处于晶胞内部.
解答:解:在A、B、C三种元素中,A元素原子的价电子排布为2s22p5,则A氟元素;B元素K、L能层上的电子数与M、N层上的电子数相同,则B原子核外电子数为(2+8)×2=20,故B为Ca元素;C元素的原子序数等于A、B两元素原子序数之和,则C为Cu元素,
(1)F元素电负性为4.0,Cu元素的电负性数值为1.9,两元素的电负性之差为2.1,大于1.7,则F、Cu两元素的原子之间应形成离子键,故答案为:离子;
(2)Cu为29号元素,其电子排布式为3d104s1,故答案为:3d104s1;
(3)HF溶液中,存在氢键有:F-H…F、F-H…O、O-H…F、O-H…O,故答案为:4;
(4)SO42-中S原子价层电子对数=4+
=4,不含孤对电子,故S原子的杂化轨道类型是 sp3,SO42-的构型是正四面体,
故答案为:sp3;正四面体;
(5)铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则晶胞中Cu原子数目=6×
=3,晶胞中Au原子数目=8×
=1,故晶胞中Cu原子与Au原子数量之比为3:1,铜金合金晶体属于金属晶体,含有化学键类型为金属键,
故答案为:3:1;金属键;
(6)A、B两元素所形成晶体为CaF2,晶胞中钙离子处于顶点与面心上、氟离子处于晶胞内部,
故答案为:Ca.
(1)F元素电负性为4.0,Cu元素的电负性数值为1.9,两元素的电负性之差为2.1,大于1.7,则F、Cu两元素的原子之间应形成离子键,故答案为:离子;
(2)Cu为29号元素,其电子排布式为3d104s1,故答案为:3d104s1;
(3)HF溶液中,存在氢键有:F-H…F、F-H…O、O-H…F、O-H…O,故答案为:4;
(4)SO42-中S原子价层电子对数=4+
| 6+2-2×4 |
| 2 |
故答案为:sp3;正四面体;
(5)铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则晶胞中Cu原子数目=6×
| 1 |
| 2 |
| 1 |
| 8 |
故答案为:3:1;金属键;
(6)A、B两元素所形成晶体为CaF2,晶胞中钙离子处于顶点与面心上、氟离子处于晶胞内部,
故答案为:Ca.
点评:本题为物质结构与性质综合题目,难度中等,推断元素是解题关键,(6)中注意识记课本中常见晶胞结构.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
 或
或
 (2012?武汉模拟)[化学一选修 3:物质结构与性质]有U、V、W、X、Y、Z 六种前四周期元素,原子序数依次增大,其相关信息如下表:
(2012?武汉模拟)[化学一选修 3:物质结构与性质]有U、V、W、X、Y、Z 六种前四周期元素,原子序数依次增大,其相关信息如下表: