题目内容
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1) 太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的外围电子排布式__________,它位于周期表____________区。
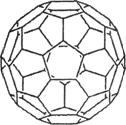
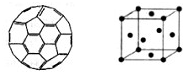
(2) 富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如右图,分子中碳原子轨道的杂化类型为________;1 mol C60分子中σ键的数目为____________个。
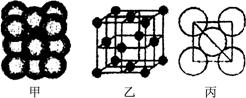
(3) Cu单质晶体中原子的堆积方式如右图甲所示,其晶胞特征如右图乙所示,原子之间相互位置关系的平面图如右图丙所示。晶胞中Cu原子的配位数为____________,一个晶胞中Cu原子的数目为________。
(4) Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于________(填晶体类型);Fe(CO)5是配合物,配体.配位数分别是________.________。
(5) 下列说法正确的是________。
A. 第一电离能大小:S>P>Si
B. 电负性顺序:C<N<O<F
C. 因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D. SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E. 分子晶体中,共价键键能越大,该分子晶体的熔.沸点越高
(1) 3d84s2(1分) d(1分)
(2) sp2(1分) 90NA(2分)
(3) 12(2分) 4(2分)
(4) 分子晶体(1分) CO(1分) 5(1分)
(5) BC(3分)
【解析】(1)根据构造原理可知基态镍原子的外围电子排布式3d84s2,它位于周期表的d区。
(2)由富勒烯的结构可知,富勒烯中每个碳原子形成3个共价键,所以其碳原子轨道的杂化类型为sp2。因为1个碳原子形成3个C-C单键,所以1 mol C60分子中σ键的数目为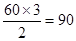 。
。
(3)由Cu单质的晶胞可知,与铜原子相邻且最近的铜原子是12个,所以其配位数是12。一个晶胞中Cu原子的数目为 。
。
(4)根据Fe(CO)5晶体的物理性质可知该晶体应属于分子晶体。由其化学式可知配体和配位数分别是CO和5.
(5)气态电中性基态原子失去1个电子转化为气态基态正离子所需要的最低能量叫做第一电离能。同周期元素自左向右第一电离能逐渐增大,但P的大于S 的,A不正确。SO2是V型结构,D不正确。分子晶体中,分子间作用力越大,该分子晶体的熔.沸点越高,E不正确。

 阅读快车系列答案
阅读快车系列答案能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的外围电子排布式__________,它位于周期表____________区。
(2)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如右图,分子中碳原子轨道的杂化类型为________;1 mol C60分子中σ键的数目为____________个。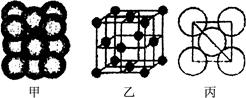
(3) Cu单质晶体中原子的堆积方式如右图甲所示,其晶胞特征如右图乙所示,原子之间相互位置关系的平面图如右图丙所示。晶胞中Cu原子的配位数为____________,一个晶胞中Cu原子的数目为________。
(4) Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于________(填晶体类型);Fe(CO)5是配合物,配体.配位数分别是________.________。
(5)下列说法正确的是________。
| A.第一电离能大小:S>P>Si |
| B.电负性顺序:C<N<O<F |
| C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低 |
| D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大 |
 (2011?德州二模)能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始开发新资源,寻求经济发展的新动力.新型电池在工业和航空航天业上被广泛开发使用.
(2011?德州二模)能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始开发新资源,寻求经济发展的新动力.新型电池在工业和航空航天业上被广泛开发使用. 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力. 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力. 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.