题目内容
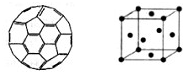 (2011?德州二模)能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始开发新资源,寻求经济发展的新动力.新型电池在工业和航空航天业上被广泛开发使用.
(2011?德州二模)能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始开发新资源,寻求经济发展的新动力.新型电池在工业和航空航天业上被广泛开发使用.(l)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途.富勒烯(C60)的结构如下图,其分子中碳原子轨道的杂化类型为
SP2
SP2
;1mol C60分子中σ键的数目为90NA
90NA
.(2)甲烷、甲醇、氢气等都可作为燃料电池的燃料.
①甲醇的熔、沸点比甲烷的熔、沸点高,其主要原因是:
甲醇分子之间有氢键
甲醇分子之间有氢键
②用钦锰储氢合金储氢,与高压氢气钢瓶相比,具有重量轻、体积小的优点.锰的基态原子核外电子排布式为:
1S22S22P63S23P63d54S2
1S22S22P63S23P63d54S2
.金属钛的晶胞是面心立方结构(如图),则钛晶体的二个晶胞中钛原子数为:4
4
,钛原子的配位数为:12
12
.分析:(1)根据富勒烯(C60)的结构可以看出每个C原子和其它三个C原子成键,为三个δ键和一个π键,由此判断杂化类型;根据C60分子中每个C原子和其它C原子形成三个δ键,平均一个C原子生成
个δ键来计算σ键的数目;
(2)①根据形成氢键的条件来分析甲醇沸点高的原因;
②利用晶胞的均摊法计算.在晶胞里面的原子记为一个;在面上的原子记为1/2个(因为这是一个原子被两个晶胞共有,每个晶胞分一半);在楞上的原子记为1/4个(这是一个原子被4个晶胞共有);在顶角上的原子记为1/8个(这是一个原子被8个晶胞共有).
| 3 |
| 2 |
(2)①根据形成氢键的条件来分析甲醇沸点高的原因;
②利用晶胞的均摊法计算.在晶胞里面的原子记为一个;在面上的原子记为1/2个(因为这是一个原子被两个晶胞共有,每个晶胞分一半);在楞上的原子记为1/4个(这是一个原子被4个晶胞共有);在顶角上的原子记为1/8个(这是一个原子被8个晶胞共有).
解答:解:(1)根据富勒烯(C60)的结构可以看出每个C原子和其它三个C原子成键,为三个δ键和一个π键,故杂化类型为SP2杂化,C60分子中每个C原子和其它C原子形成三个δ键,平均一个C原子生成
个δ键,所以1mol C60分子中σ键的数目为90NA,故答案为:SP2;90NA;
(2)①甲醇中含有-OH,其中氧元素的电负性较大,原子半径小,可以形成氢键,所以甲醇的熔、沸点比甲烷的熔、沸点高,故答案为:甲醇分子之间有氢键;
②Mn原子核外共25个电子,按照能量最低原则电子先填入能量最低的1s轨道,填满后再依次填入能量较高的轨道,其电子排布式为:1S22S22P63S23P63d54S2;金属钛晶胞中,钛原子位于晶胞的顶点和面心位置,则晶胞中含有钛原子的数目为:8×
+ 6×
=4;由于钛原子位于晶胞的顶点,为8个晶胞共有,晶胞中两个距离最近的钛原子为顶点和面心位置,故每个钛原子周围距离相等且最近的有8×
=12个,故答案为:1S22S22P63S23P63d54S2;4;12.
| 3 |
| 2 |
(2)①甲醇中含有-OH,其中氧元素的电负性较大,原子半径小,可以形成氢键,所以甲醇的熔、沸点比甲烷的熔、沸点高,故答案为:甲醇分子之间有氢键;
②Mn原子核外共25个电子,按照能量最低原则电子先填入能量最低的1s轨道,填满后再依次填入能量较高的轨道,其电子排布式为:1S22S22P63S23P63d54S2;金属钛晶胞中,钛原子位于晶胞的顶点和面心位置,则晶胞中含有钛原子的数目为:8×
| 1 |
| 8 |
| 1 |
| 2 |
| 3 |
| 2 |
点评:本题考查杂化类型和晶体结构的分析,做题时注意晶胞的分析多利用均摊法,题目较为综合,但难度一般.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目