题目内容
(12分)某化学研究性学习小组进行了一系列“带火星的木炭复燃”的实验,实验装置如右图所示。
(1)甲组同学探究“使带火星木炭复燃时O2的体积分数的极限”。将氧气和空气(假定空气中O2的体积分数为20%)按不同的体积比混合得100mL气体A进行实验,实验记录如下:
编号 | I | II | III | IV | V |
V(O2)/mL | 60 | 40 | 20 | 12 | 10 |
V(空气)/mL | 40 | 60 | 80 | 88 | 90 |
现象 | 木炭复燃 | 木炭复燃 | 木炭复燃 | 木炭有时燃烧,有时不燃烧 | 木炭 不复燃 |
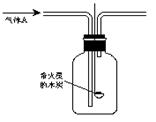 回答下列问题:
回答下列问题:
①使带火星木炭复燃的O2的体积分数最小约为 。
②用带火星木炭检验集气瓶里是否集满O2,若木炭复燃,能否认为集气瓶里的气体一定是纯净的O2?答: (填“能”或“否”)。
③若按照3∶2的比例混合O2和CO2气体,该混合气体能否使带火星的木炭复燃?
答: (“能”、“否”或“不一定”)。
(2)乙组同学探究“NO2能否支持燃烧”的问题,设计了如下几组实验,实验记录及结论如下:
编号 | 制取气体A(下列反应产生的混合气体) | B中的现象 | 结论 |
a | 在烧瓶中加热适量浓HNO3 4HNO3 △ 4NO2↑+O2↑+2H2O↑ | 充满红棕色气体,木炭不复燃,火星熄灭 | NO2不支持燃烧 |
b | 加热AgNO3固体 2AgNO3 △ 2NO2↑+O2↑+2Ag | 充满红棕色气体,木炭复燃 | NO2支持燃烧 |
c | 加热Cu(NO3)2固体 2Cu(NO3)2 △ 4NO2↑+O2↑+2CuO | 充满红棕色气体,木炭复燃 | NO2支持燃烧 |
你认为a、b、c三个结论是否可靠?说出你的理由。
a. ,原因是 。
b. ,原因是 。
c. ,原因是 。
(1)①29.6% (2分) ②否 (2分) ③能(2分)
(2) a.不可靠(1分) 反应产生的水蒸气及从溶液中蒸发出来的水蒸气可使木炭火星熄灭(1分)
b.不可靠(1分) 反应产生的气体中O2的体积分数为1/3,高于29.6%,木炭复燃可能是由于O2浓度增大所致(1分)
c.可靠(1分) 反应产生的气体中O2的体积分数为1/4,低于29.6%,如果NO2不支持燃烧,木炭就不会复燃。(1分)

 某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO
某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO
 (2011?泰州一模)某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
(2011?泰州一模)某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
