题目内容
11.常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7.下列关于滤液中的离子浓度关系不正确的是( )| A. | c(H+)+c(NH4+ )=c(OH- )+c(HCO3-)+2c(CO32-) | |
| B. | c(Na+ )=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | $\frac{{K}_{w}}{c({H}^{+})}$<1.0×10-7mol/L | |
| D. | c(Cl-)>c(NH4+)>c(HCO3-)>c(CO32-) |
分析 A.根据混合液中的电荷守恒进行计算;
B.根据物料守恒即c(Na)=c(C)分析;
C.根据Kw=c(H+)×c(OH-)=1.0×10-14计算;
D.铵根离子部分水解,则c(Cl-)>c(NH4+),HCO3-的电离程度很小.
解答 解:A.溶液中存在电荷守恒:c(Na+)+c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),由于析出部分NaHCO3晶体,则c(Na+)<c(Cl-),所以c(H+)+c(NH4+)>c(OH-)+c(HCO3-)+2c(CO32-),故A错误;
B.溶液中存在物料守恒,即:c(Na)=c(C),则:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故B正确;
C.水的离子积为:Kw=c(H+)×c(OH-)=1.0×10-14,已知pH<7,则c(H+)>1.0×10-7mol/L,所以$\frac{{K}_{W}}{c({H}^{+})}$<1.0×10-7mol/L,故C正确;
D.铵根离子部分水解,则c(Cl-)>c(NH4+),由于析出部分NaHCO3晶体,则HCO3-浓度减小,HCO3-的电离程度很小,所以c(CO32-)最小,即c(Cl-)>c(NH4+)>c(HCO3-)>c(CO32-),故D正确;
故选A.
点评 本题考查离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒即盐的水解原理的含义为解答关键,注意熟练掌握判断离子浓度大小常用方法,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
5.想一想,NaOH固体,P2O5固体,无水CaCl2为什么可以归为一类?据此,与这三种物质可归为一类的是( )
| A. | 10%的H2SO4溶液 | B. | NaCl | ||
| C. | 碱石灰(固体,含NaOH,CaO) | D. | Ca(OH)2 |
2.在一定温度下,硫酸铜晶体的培养皿中存在下列平衡:Cu2++SO42-+x H2O?CuSO4•xH2O,当向硫酸铜溶液中加少量无水硫酸铜粉末后,下列说法中正确的是( )
| A. | 溶液中Cu2+浓度增大 | B. | 溶液中Cu2+数目减少 | ||
| C. | 该硫酸铜晶体体积增大 | D. | 溶液的蓝色变浅 |
19.下列设备工作时,将化学能转变为电能的是( )
| A. |  太阳能集热器 | B. |  锂离子电池 | C. |  电烤箱 | D. |  燃气灶 |
1.关于合成氨反应N2(g)+3H2(g)?2NH3(g)达到限度时,下列叙述正确的是( )
| A. | N2和H2全部转化为NH3 | |
| B. | 正反应和逆反应的化学反应速率均为零 | |
| C. | N2、H2和NH3的物质的量浓度之比为1:3:2 | |
| D. | 若外界条件发生改变,化学反应的限度可能随之改变 |
 某同学想通过比较元素的最高价氧化物对应的水化物的酸性强弱来证明硫和碳的得电子能力强弱,设计了如图所示装置进行探究.
某同学想通过比较元素的最高价氧化物对应的水化物的酸性强弱来证明硫和碳的得电子能力强弱,设计了如图所示装置进行探究.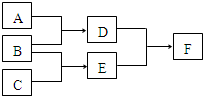 单质A、B、C和化合物D、E、F,在一定条件下有如图的转化关系(可能有部分生成物未标出),请回答下列问题:
单质A、B、C和化合物D、E、F,在一定条件下有如图的转化关系(可能有部分生成物未标出),请回答下列问题: