题目内容
【题目】研究和开发CO、CO2的应用及水体污染的治理是化学工作者研究的重要课题。
(1)水体常见污染物之一的氨氮主要指游离氨或铵盐,可以通入一定量的氯气,利用产生的HClO除去。已知: NH4++HClO=NH2Cl+H++H2O;ΔH=a kJ·mol-1
NH4++4HClO=NO3- +6H++4Cl-+H2O;ΔH=b kJ·mol-1。
2NH2Cl+HClO=N2+H2O+3H++3Cl-;ΔH=c kJ·mol-1
则2NH4++3HClO=N2+3H2O+5H++3Cl-;ΔH=_____ kJ·mol-1
(2)将CO2与金属钠组合设计成Na-CO2电池,很容易实现可逆的充、放电反应,该电池反应为4Na+3CO2![]() 2Na2CO3+C。放电时当电路中转移1mol电子时被还原的CO2的质量为_____;充电时,阳极的反应式为________
2Na2CO3+C。放电时当电路中转移1mol电子时被还原的CO2的质量为_____;充电时,阳极的反应式为________
(3)废水中重金属离子常用沉淀法除去,已知Ksp(NiS)=1.1×10-21,Ksp(CuS)=1.3×10-36,国家规定的排放标准:镍低于1.1×10-5 mol·L-1,铜低于7.8×10-5 mol·L-1。则需要控制溶液中S2-的浓度不低于_____________mol·L-1。
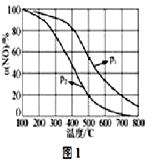
(4)NO易被O2氧化为NO2。其他条件不变时,NO的氧化率α(NO)与温度、压强的关系如图1所示(p1线在p2的上方)则p1__p2(填“>”、“<”或“=”);温度高于800℃时,α(NO)几乎为0的原因是____
(5)环境中的有害物质常通过转化为CO2来降低污染,TiO2是一种性能优良的半导体光催化剂,能有效地将有机污染物转化为CO2等小分子物质。下图2为在TiO2的催化下,O3降解CH3CHO的示意图,则该反应的化学方程式为_____。
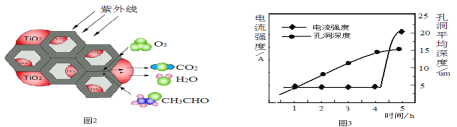
(6)用新型钛基纳米PbO2作电极可将苯、酚类等降解为CO2 和H2O。该电极可通过下面过程制备:将钛基板用丙酮浸泡后再用水冲洗,在钛板上镀上一层铝膜。用它做阳极在草酸溶液中电解,一段时间后,铝被氧化为氧化铝并同时形成孔洞。再用Pb(NO3)2溶液处理得纳米PbO2,除去多余的氧化铝,获得钛基纳米PbO2电极。电解时,电流强度和基板孔洞深度随时间变化如上图3所示,氧化的终点电流强度突然增加,其可能的原因是____。
【答案】2a+c 11g C-4e-+2CO32-=3CO2↑ 10-16mol/L > NO2在高温时分解了 3CH3CHO+5O3=6CO2+6H2O 铝氧化完成时形成的孔洞到达金属钛表面,钛的导电性强,所以电流突然增加
【解析】
(1)①NH4++HClO═NH2Cl+H++H2O△H=a kJ·mol﹣1;②2NH2Cl+HClO═N2+H2O+3H++3Cl﹣△H=c kJ·mol﹣1,根据盖斯定律进行计算;
(2)放电时为原电池,二氧化碳气体被还原,根据4Na+3CO2![]() 2Na2CO3+C反应可知,CO2→C,价态降低4价,转移电子为4e-,据此进行计算;充电时为电解池,阳极发生氧化反应,碳被氧化为二氧化碳,据此写出阳极的反应式;
2Na2CO3+C反应可知,CO2→C,价态降低4价,转移电子为4e-,据此进行计算;充电时为电解池,阳极发生氧化反应,碳被氧化为二氧化碳,据此写出阳极的反应式;
(3)Ksp(NiS)=c(Ni2+)c(S2﹣)=1.1×10﹣21,可以求出c(S2﹣),Ksp(CuS)=c(Cu2+)c(S2﹣)=1.3×10﹣36,求出c(S2﹣),据此进行分析;
(4)根据图像分析,温度相同时p1的一氧化氮的转化率大,所以增大压强平衡正向移动,α(NO)几乎为0的原因是NO2几乎完全分解;
(5)臭氧和乙醛在紫外线的作用下生成二氧化碳和水,据此写出方程式;
(6)电解时,电流强度和基板孔洞深度随时间如图所示,氧化的终点电流突然增加的原因是铝氧化完成时,形成的孔洞到达金属钛表面,钛的导电性强,所以电流突然增加。
(1)①NH4++HClO═NH2Cl+H++H2O△H=a kJ·mol﹣1;②2NH2Cl+HClO═N2+H2O+3H++3Cl﹣△H=c kJ·mol﹣1,2×①+②得,2NH4++3HClO═N2+3H2O+5H++3Cl﹣△H=(2a+c)kJ·mol﹣1;
故答案为:2a+c;
(2)放电时为原电池,二氧化碳气体被还原,根据4Na+3CO2![]() 2Na2CO3+C反应可知,CO2→C,价态降低4价,转移电子为4e-;当电路中转移1mol电子时被还原的CO2的量为0.25mol,质量为0.25mol×44g/mol=11g;充电时为电解池,阳极发生氧化反应,碳被氧化为二氧化碳,阳极的反应式为C-4e-+2CO32-=3CO2↑;
2Na2CO3+C反应可知,CO2→C,价态降低4价,转移电子为4e-;当电路中转移1mol电子时被还原的CO2的量为0.25mol,质量为0.25mol×44g/mol=11g;充电时为电解池,阳极发生氧化反应,碳被氧化为二氧化碳,阳极的反应式为C-4e-+2CO32-=3CO2↑;
故答案是:11g;C-4e-+2CO32-=3CO2↑;
(3)Ksp(NiS)=c(Ni2+)c(S2﹣)=1.1×10﹣21,则c(S2﹣)= ![]() =
=![]() =10﹣16mol·L﹣1,Ksp(CuS)=c(Cu2+)c(S2﹣)=1.3×10﹣36,c(S2﹣)=
=10﹣16mol·L﹣1,Ksp(CuS)=c(Cu2+)c(S2﹣)=1.3×10﹣36,c(S2﹣)= ![]() =1.3×10﹣36/7.8×10-5=1.7×10﹣32mol·L﹣1,1.7×10﹣32mol·L﹣1<10﹣16mol·L﹣1,故则需要控制溶液中S2﹣的浓度不低于10﹣16mol·L﹣1;
=1.3×10﹣36/7.8×10-5=1.7×10﹣32mol·L﹣1,1.7×10﹣32mol·L﹣1<10﹣16mol·L﹣1,故则需要控制溶液中S2﹣的浓度不低于10﹣16mol·L﹣1;
故答案为:10﹣16;
(4)温度相同时p1的一氧化氮的转化率大,所以增大压强平衡正向移动,所以p1> p2;α(NO)几乎为0的原因是无二氧化氮,NO2几乎完全分解;
答案是
(5)根据题意可知,臭氧和乙醛在紫外线的作用下生成二氧化碳和水,方程式为:3CH3CHO+5O3![]() 6CO2+6H2O;
6CO2+6H2O;
故答案是:3CH3CHO+5O3![]() 6CO2+6H2O;
6CO2+6H2O;
(6)电解时,电流强度和基板孔洞深度随时间如图所示,氧化的终点电流突然增加的原因是铝氧化完成时,形成的孔洞到达金属钛表面,钛的导电性强,所以电流突然增加;
故答案是:铝氧化完成时形成的孔洞到达金属钛表面,钛的导电性强,所以电流突然增加。

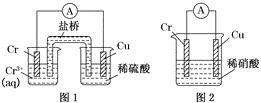
【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 比较Cl2与H2SO4氧化性强弱 | 向漂白粉中加入4mol·L-1硫酸,观察有无黄绿色气体 |
B | 向浓度均为0.10molL-1的KCl和KI混合溶液中滴加少量AgNO3稀溶液,出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
C | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I3- |
D | 向苯酚钠溶液中通入CO2,溶液变浑浊 | 结合H+能力: C6H5O->CO32- >HCO3- |
A.AB.BC.CD.D