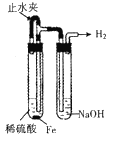
题目内容
【题目】碳酸钠是一种重要的化工原料,主要采用氨碱法生产。回答下列问题:
(1)碳酸钠俗称 , 可作为碱使用的原因是(用离子方程式表示)。
(2)已知:①2NaOH(s)+CO2(g) ![]() Na2CO3(s)+H2O(g) ΔH1=127.4 kJ·mol1 ②NaOH(s)+CO2(g)
Na2CO3(s)+H2O(g) ΔH1=127.4 kJ·mol1 ②NaOH(s)+CO2(g) ![]() NaHCO3(s) ΔH1=131.5 kJ·mol1
NaHCO3(s) ΔH1=131.5 kJ·mol1
反应2Na2CO3(s) ![]() Na2CO3(s)+ H2O(g) +CO2(g)的ΔH= kJ·mol1 , 该反应的平衡常数表达式K=。
Na2CO3(s)+ H2O(g) +CO2(g)的ΔH= kJ·mol1 , 该反应的平衡常数表达式K=。
(3)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中 ![]() =。已知Ksp(BaCO3)=2.6×109 , Ksp(BaSO4)=1.1×1010。
=。已知Ksp(BaCO3)=2.6×109 , Ksp(BaSO4)=1.1×1010。
【答案】
(1)纯碱;CO32﹣+H2O?HCO3﹣+OH﹣
(2)+135.6;c(H2O)?c(CO2)
(3)![]()
【解析】解:(1)碳酸钠俗称纯碱;Na2CO3为强碱弱酸盐,CO32﹣离子水解方程式为CO32﹣+H2OHCO3﹣+OH﹣ , 使溶液呈碱性, 所以答案是:纯碱;CO32﹣+H2OHCO3﹣+OH﹣;(2)①2NaOH(s)+CO2(g)═Na2CO3(s)+H2O(g)△H1=﹣127.4kJmol﹣1
②NaOH(s)+CO2(g)═NaHCO3(s)△H1=﹣131.5kJmol﹣1
, ①﹣2×②得,2NaHCO3(s)═Na2CO3(s)+H2O(g)+CO2(g)△H=+135.6kJmol﹣1;K=c(H2O)c(CO2),
所以答案是:+135.6;c(H2O)c(CO2);(3)Ksp(Ba SO4)=c(Ba2+)(SO42﹣)=1.1×10﹣10;Ksp(BaCO3)=c(Ba2+)c(CO32﹣)=2.6×10﹣9 ,
所以 ![]() =
= ![]() =
= ![]() =
= ![]() ,
,
所以答案是: ![]() .
.
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热.

 发散思维新课堂系列答案
发散思维新课堂系列答案